Leitlinien Essentials
Diagnostische und therapeutische Standards in der Dermatologischen Onkologie, adaptiert nach den aktuellen Leitlinien.
Maligner Hauttumor mit einem hohen Metastasierungsrisiko, die Inzidenz des Melanoms ist in den letzten Jahrzehnten stark angestiegen. Die Prognose ist abhängig von einer möglichst frühzeitigen Diagnosestellung und Therapie.
OP
a. Vollständige Resektion mit kleinem Sicherheitsabstand bei V. a. MM
b. Nachresektion unter Berücksichtigung der Tumordicke, zur Tiefe bis zur Faszie (keine Resektion der Faszie)

SLNB
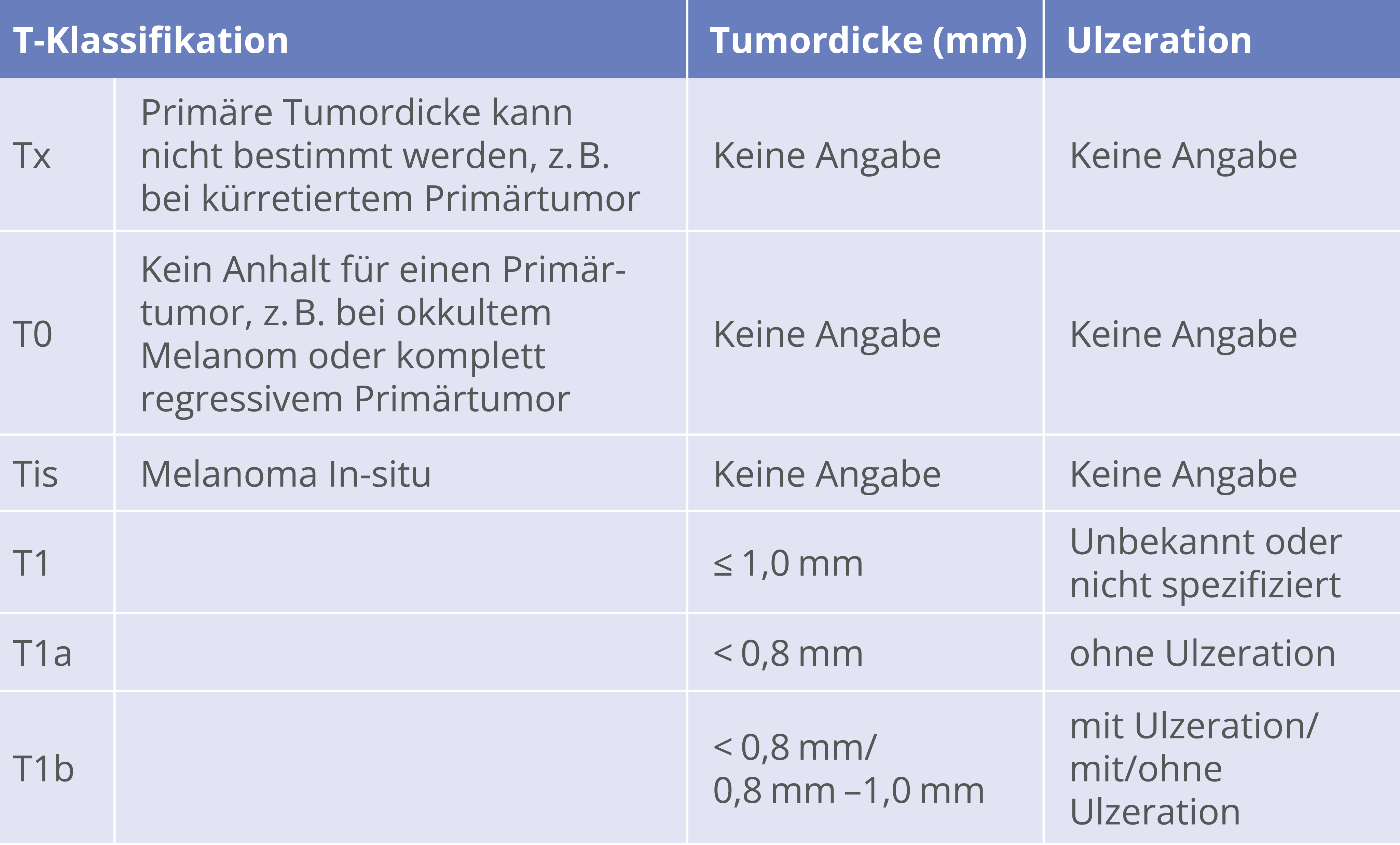
Ab 1,0 mm TD und ohne Hinweise auf lokoregionale oder Fernmetastasierung, ab TD 0,75 – 1 mm bei Ulzeration, erhöhter Mitoserate und/oder Alter < 40 Jahre
Diagnostik (Bildgebung, Labor)
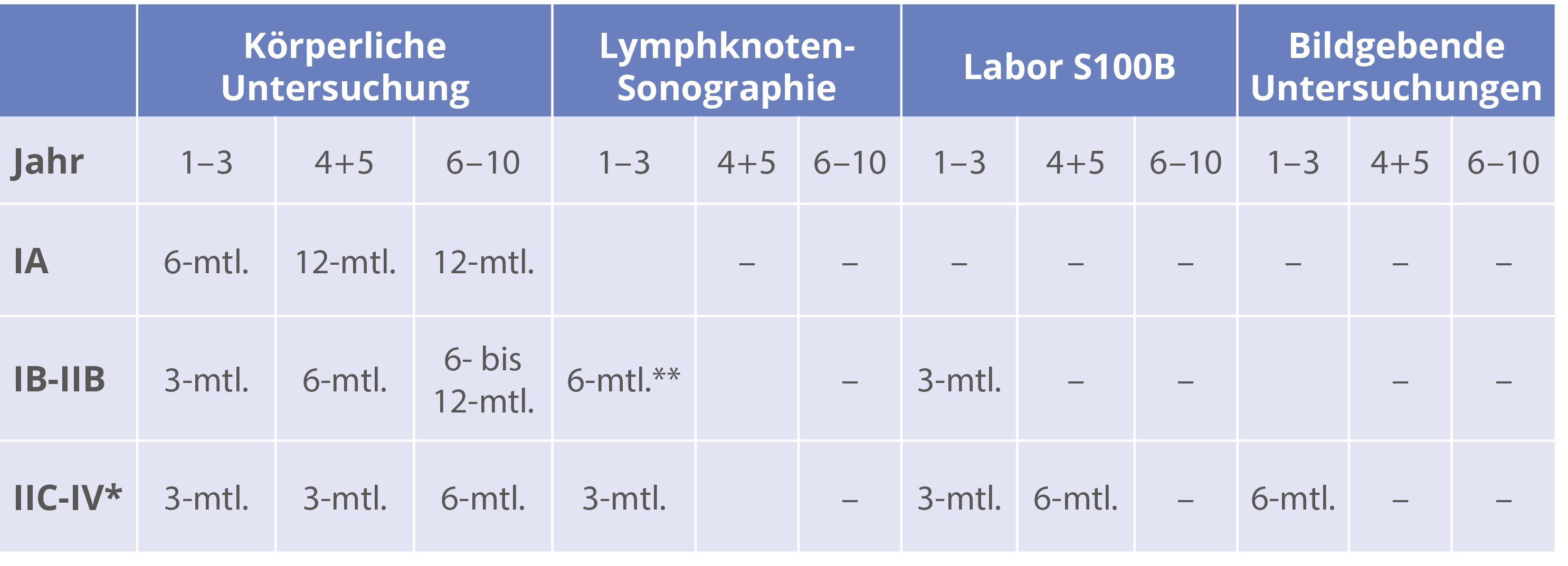
LK-Sono und S-100: ab Stadium IB
Schnittbildgebung (MRT-Kopf + CT/MRT-Ganzkörper oder PET-CT): ab Stadium IIC
Tumorkonferenz ab Stadium IIB
Strahlentherapie
a. Lentigo-maligna-Melanome bei für eine OP ungeeignete Patienten (Alter, Ausdehnung, Lage)
b. R1- oder R2-Befunde ohne Möglichkeit der Nachresektion zur lokalen Tumorkontrolle
c. Desmoplastische Melanome ohne ausreichenden SA (< 1 cm bzw. R1/R2), postoperativ zur lokalen Tumorkontrolle
Adjuvante Therapie
Stadium IIB/IIC: PD-1-Inhibitor (Pembrolizumab oder Nivolumab) über 12 Monate, bei Patienten unter medikamentöser Therapie im Stadium IIB Schnittbildgebung erwägen
Stadium III: PD-1-Inhibitor (Pembrolizumab oder Nivolumab) oder zielgerichtete Therapie (Dabrafenib und Trametinib)
Stadium IV und „no evidence of disease“: Nivolumab
Diagnostik ggf. erweitern
LK-Sono, MRT-Kopf, CT/MRT-Ganzkörper oder PET-CT, S100, BRAF-Analyse
CLND nur in Einzelfällen
Strahlentherapie, postoperativ
Ausgedehnter LK-Befall im LK-Dissektat (≥ 3 LK +, LK-Metastase > 3 cm, Kapseldurchbruch); Diskussion mit Patienten, da nur Verbesserung der lokalen Tumorkontrolle.
Adjuvante Therapie
Ab Stadium IIIA: PD-1-Inhibitor (Pembrolizumab oder Nivolumab) oder zielgerichtete Therapie (Dabrafenib und Trametinib) jeweils über 12 Monate
- Wenn möglich histologische Sicherung der Metastasierung
- Diagnostik ggf. erweitern
LK-Sono, MRT-Kopf, CT/MRT-Ganzkörper oder PET-CT, S100 + LDH, BRAF-Analyse - Tumorkonferenz
- Therapeutische Lymphadenektomie erwägen
Ggf. neoadjuvante/perioperative Therapie nach dem SWOG-Schema mit 200 mg Pembrolizumab in 3-wöchigen Abständen insgesamt dreimalig präoperativ* oder Nivolumab + Ipilimumab gemäß NADINA-Studie für 2 Gaben. Beachte: neoadjuvante Therapie nicht zugelassen. Auch neoadjuvante Therapie mit Daromun überlegen, hier aktuell Early Access Program (EAP). - Strahlentherapie, postoperativ, falls
Ausgedehnter LK-Befall im LK-Dissektat (≥ 3 LK +, LK-Metastase > 3 cm, Kapseldurchbruch) - Adjuvante Therapie
PD-1 Inhibitor (Pembrolizumab oder Nivolumab) oder zielgerichtete Therapie (Dabrafenib und Trametinib) jeweils über 12 Monate
* Falls eine perioperative Therapie erfolgt ist, sollte die Therapie (Gesamtdosis in 12 Monaten) entsprechend der vorab verabreichten Dosierung vermindert werden.
OP
a. Falls R0-Resektion perspektivisch möglich, chirurgische Therapie mit Schnittrandkontrolle
b. Bei multiplen Metastasen OP kritisch erwägen
c. Neoadjuvante Therapie mit Daromun, momentan EAP (Stand 01/2025)
Diagnostik (Bildgebung, Labor)
a. Schnittbildgebung (MRT-Kopf + CT/MRT-Ganzkörper oder PET-CT)
b. S-100, LDH
c. Mutationstestung BRAF, NRAS bei BRAF wildtype, c-KIT bei ALM und Schleimhautmelanom
d. Histologische Sicherung anstreben
e. Tumorkonferenz
Therapie /lokale Tumorkontrolle
a. Injektion von T-VEC
b. Injektion von IL-2 (off label)
c. Radiatio / Kryotherapie / Imiquimod
d. Elektrochemotherapie
f. Beginn einer Systemtherapie erwägen
Diagnostik (Bildgebung, Labor)
a. Schnittbildgebung (MRT-Kopf + CT/MRT-Ganzkörper oder PET-CT)
b. S-100, LDH
c. Mutationstestung BRAF, NRAS bei BRAF wildtype, c-KIT bei ALM und
Schleimhautmelanom
d. Histologische Sicherung anstreben
e. Tumorkonferenz
Therapie / lokale Tumorkontrolle bei Oligometastasierung
a. Operative Resektion
b. Stereotaxie
c. Lokal ablative Verfahren, z. B. SIRT bei Lebermetastasen
d. Beginn einer (adjuvanten) Systemtherapie erwägen
Medikamentöse Therapie
Klinische Studien: Für Patienten mit malignem Melanom ist die Teilnahme an klinischen Studien zu neuen Therapieansätzen eine wichtige Option. Eine Übersicht über aktuelle Studien befindet sich im ADO Studiennavigator (über https://www.ado-homepage.de/fuer-aerzte/studiennavigator.html)
Immuncheckpoint-Inhibitoren (ICIs): ICIs wie Ipilimumab und Nivolumab oder Pembrolizumab können in Kombination oder als Einzeltherapie eingesetzt werden.
Zielgerichtete Therapie für BRAFV600-positive Tumoren:
Dabrafenib/Trametinib, Vemurafenib/Cobimetinib oder Encorafenib/Binimetinib
Andere Systemtherapien
- Dacarbacin
- Larotrectinib & Entrectinib (NTRK-Fusion muss nachgewiesen werden)
- Lenvatinib + Pembrolizumab (off label)
- Je nach Allgemeinzustand kann auch ein Vorgehen im Sinne von best supportive care sinnvoll sein.
* für R0-resezierte Stadien
** nur bei korrektem pathologischem Staging mittels WLKB, sonst wie IIC
Weitere Informationen
Adaptiert nach
1. S3-Leitlinie zur Diagnostik, Therapie und Nachsorge des Melanom, AWMFRegister- Nummer 032/0240L; https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Melanom/Melanom_Version_3/LL_Melanom_Kurzversion_3.3.pdf (abgerufen 06.01.2025)
2. NCCN-guidelines Melanoma: cutaneous, Version 1.2025; https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Melanom/Melanom_Version_3/LL_Melanom_Kurzversion_3.3.pdf (abgerufen 06.01.2025)
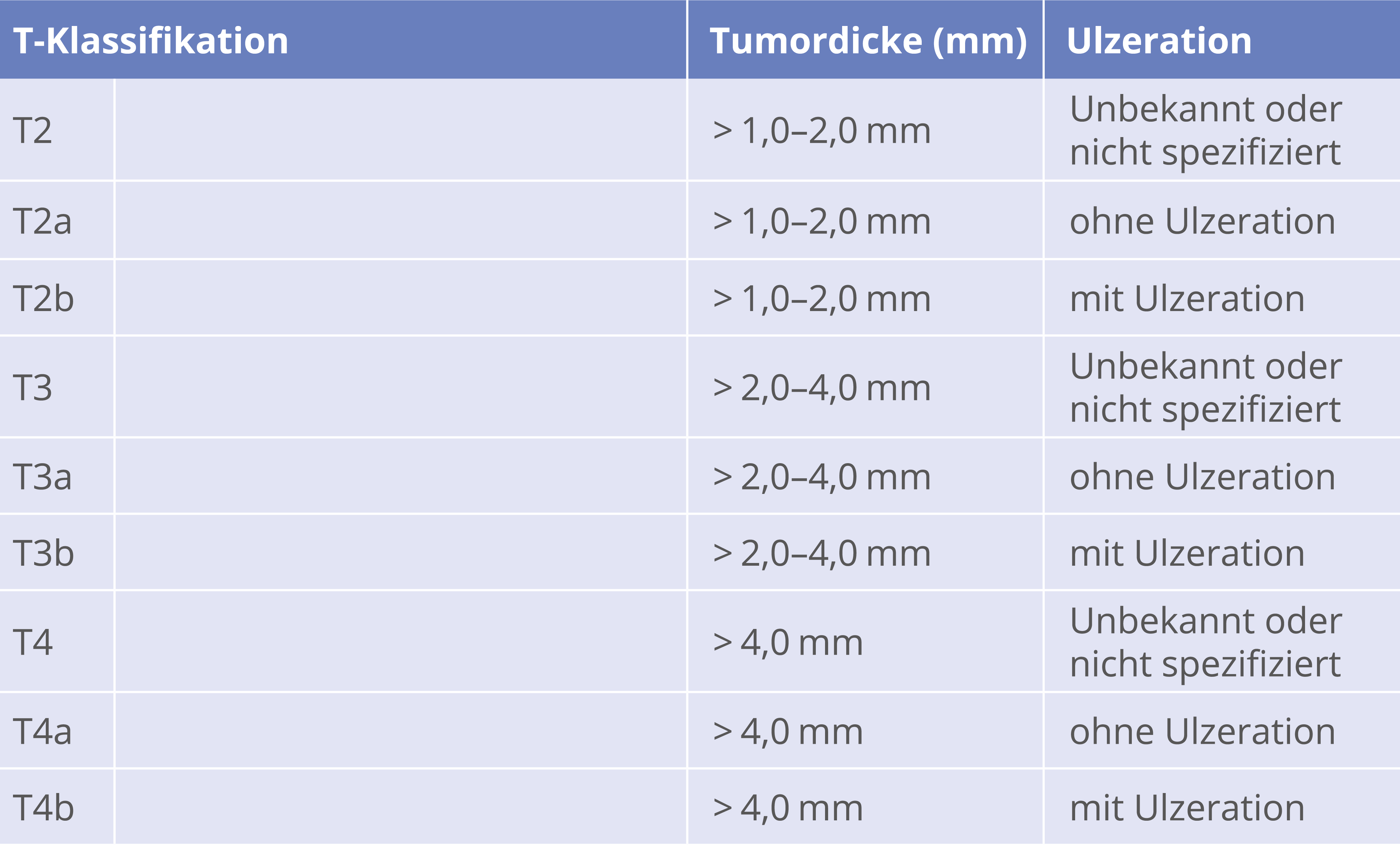
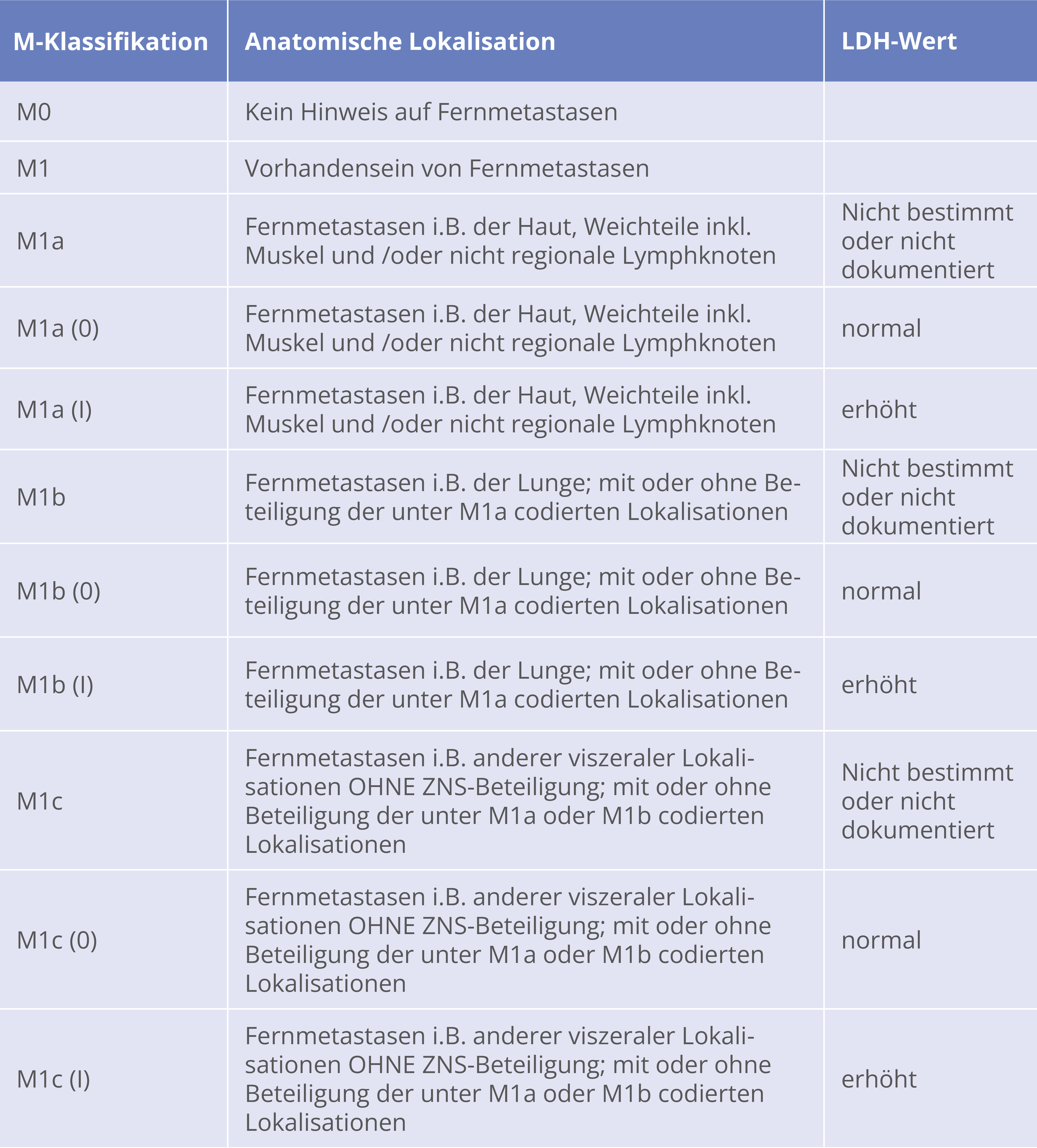
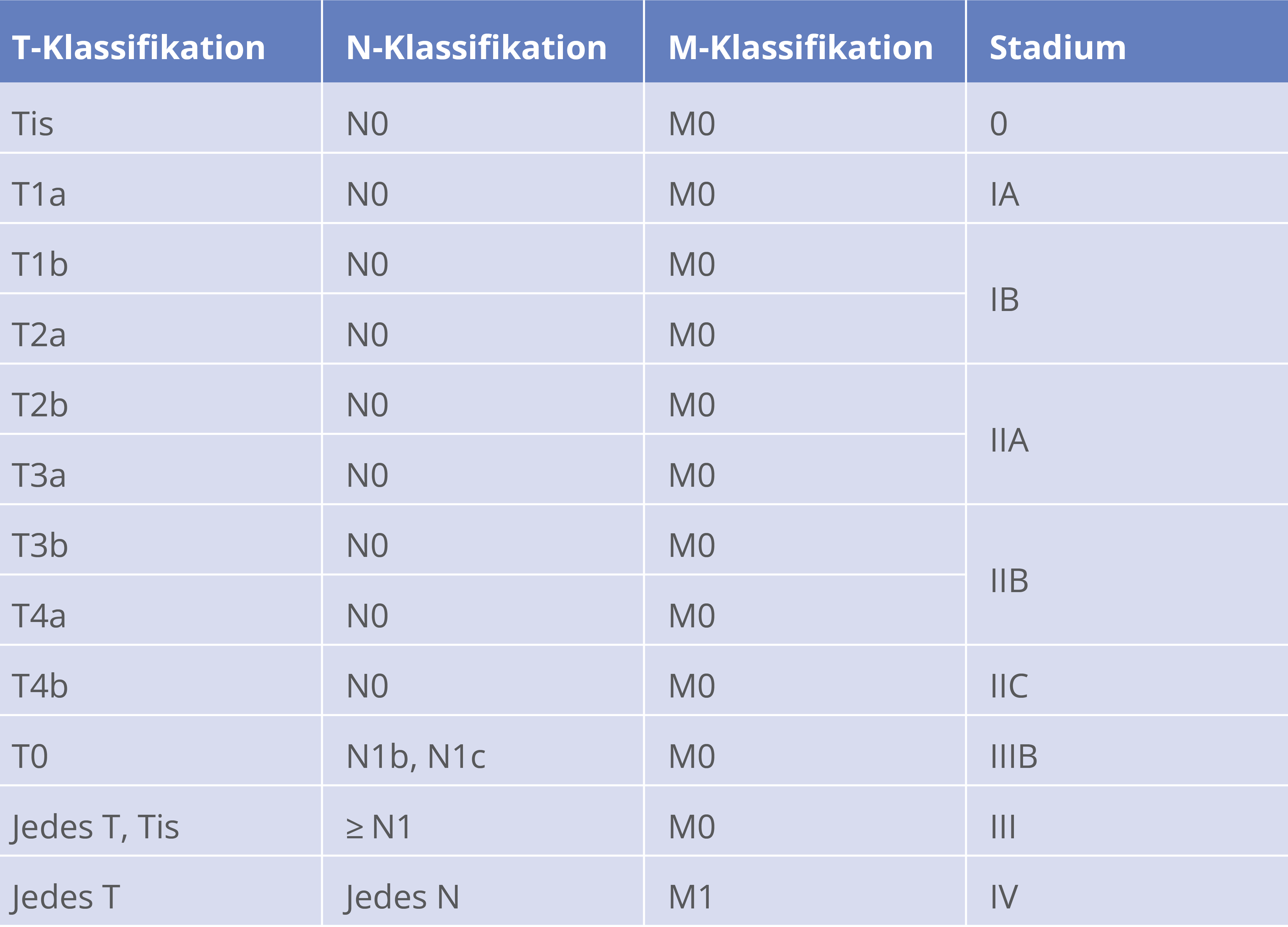
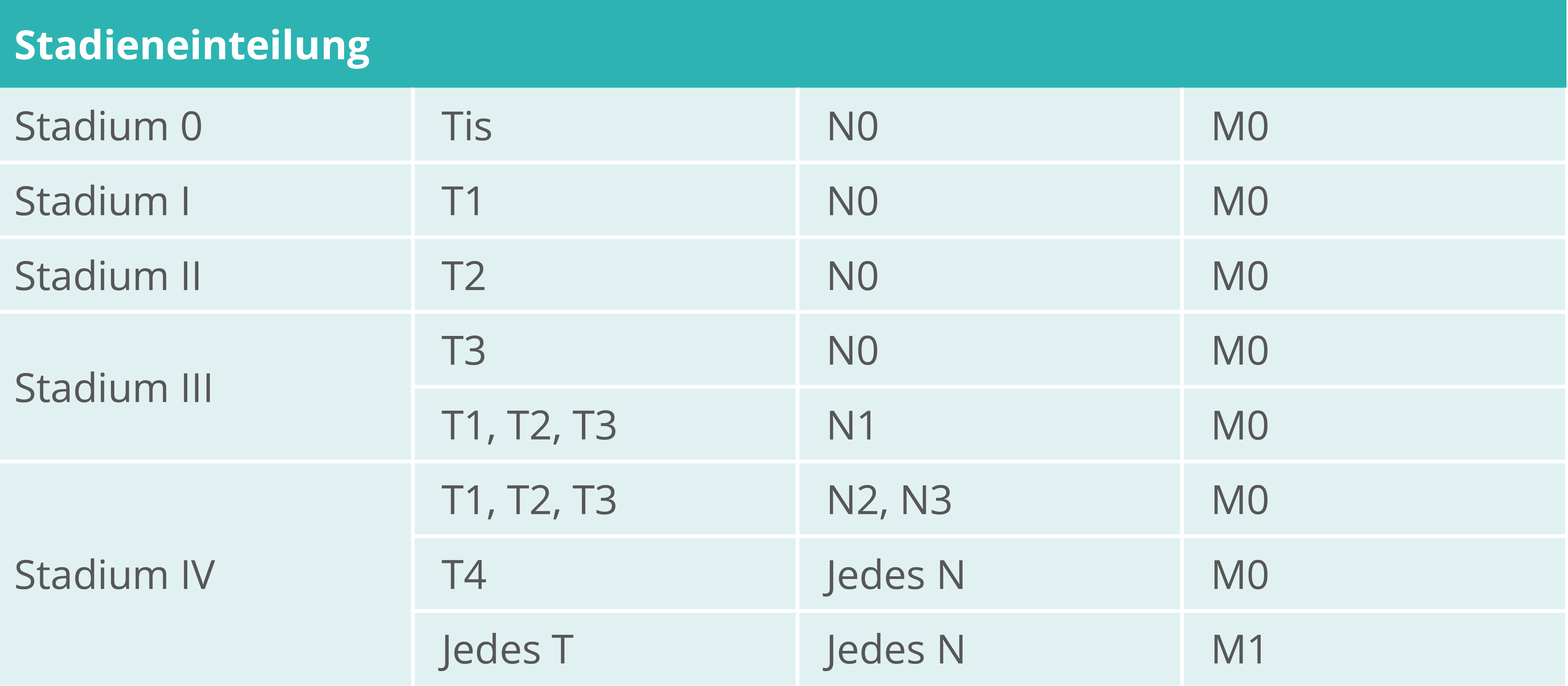
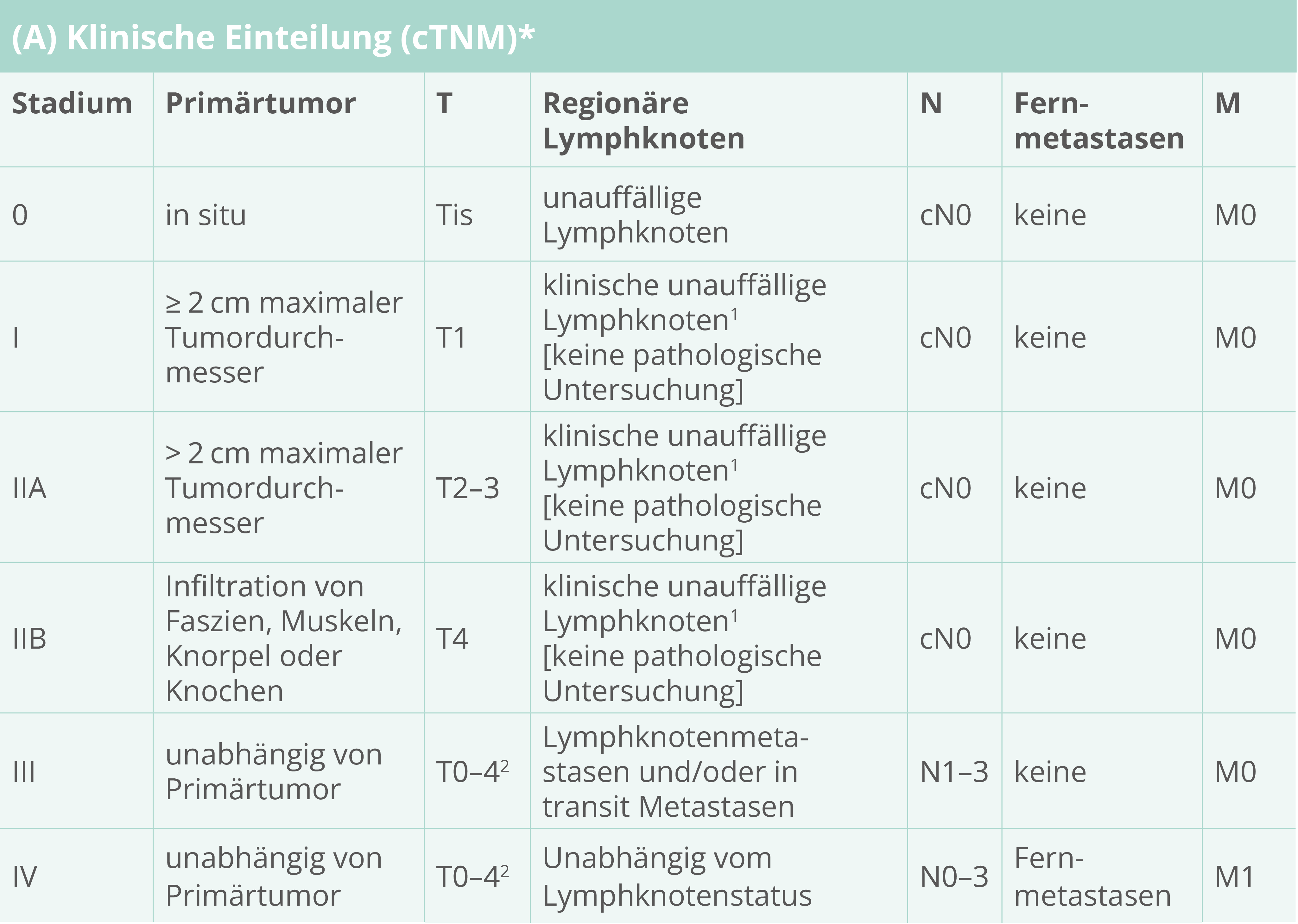
Stadieneinteilung des malignen Melanoms-klinisch (AJCC 2016/ UICC 2016)
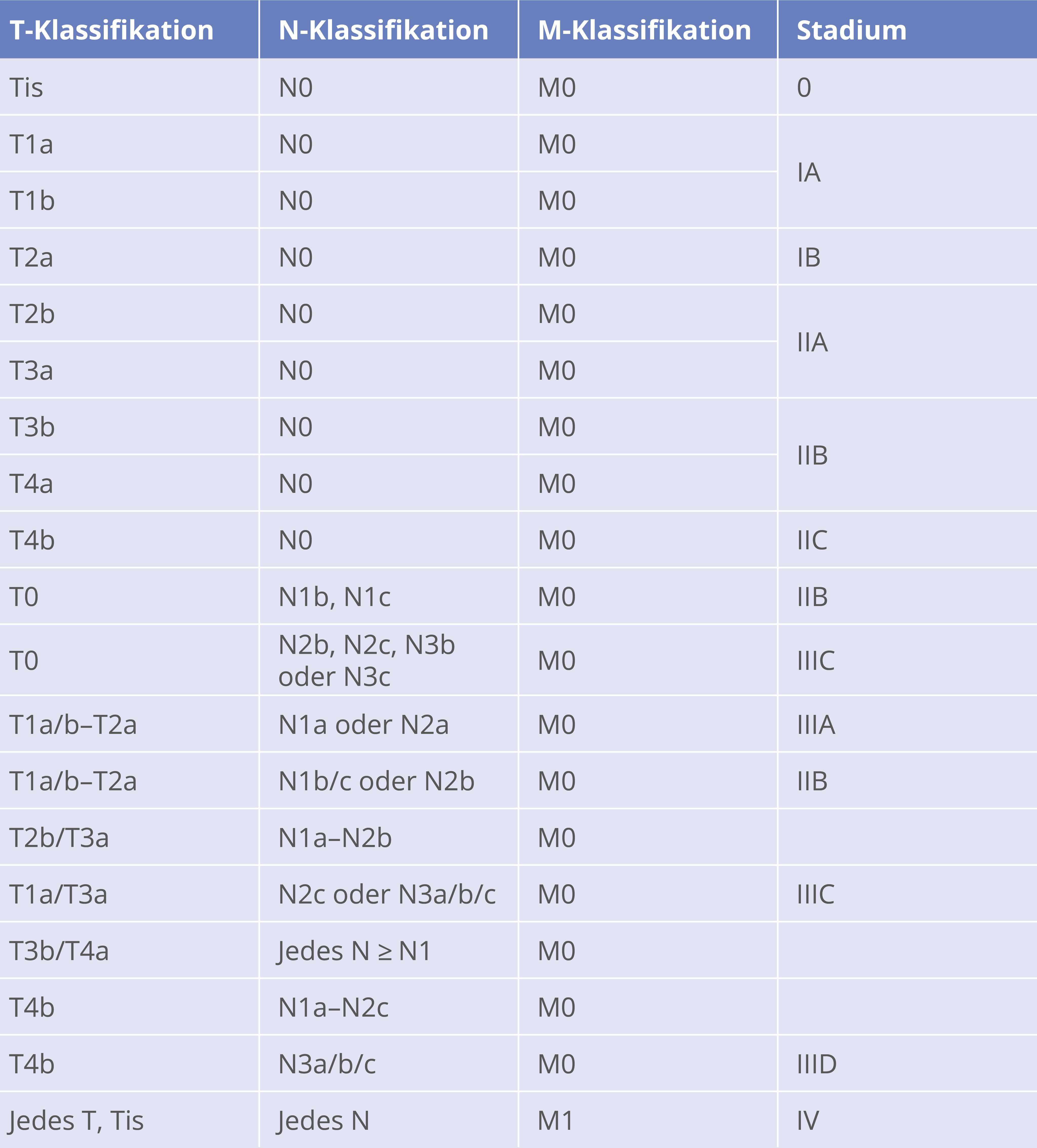
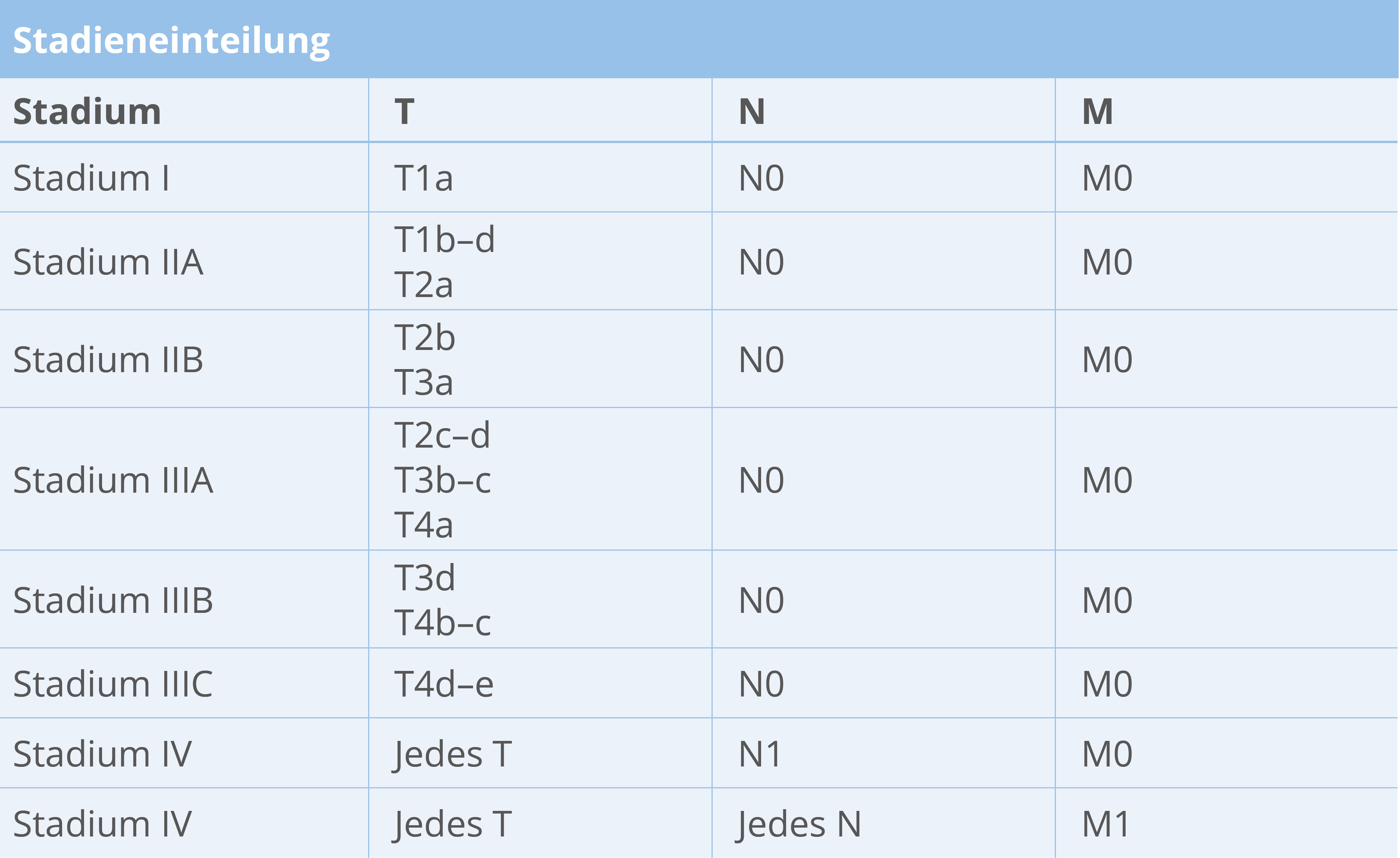
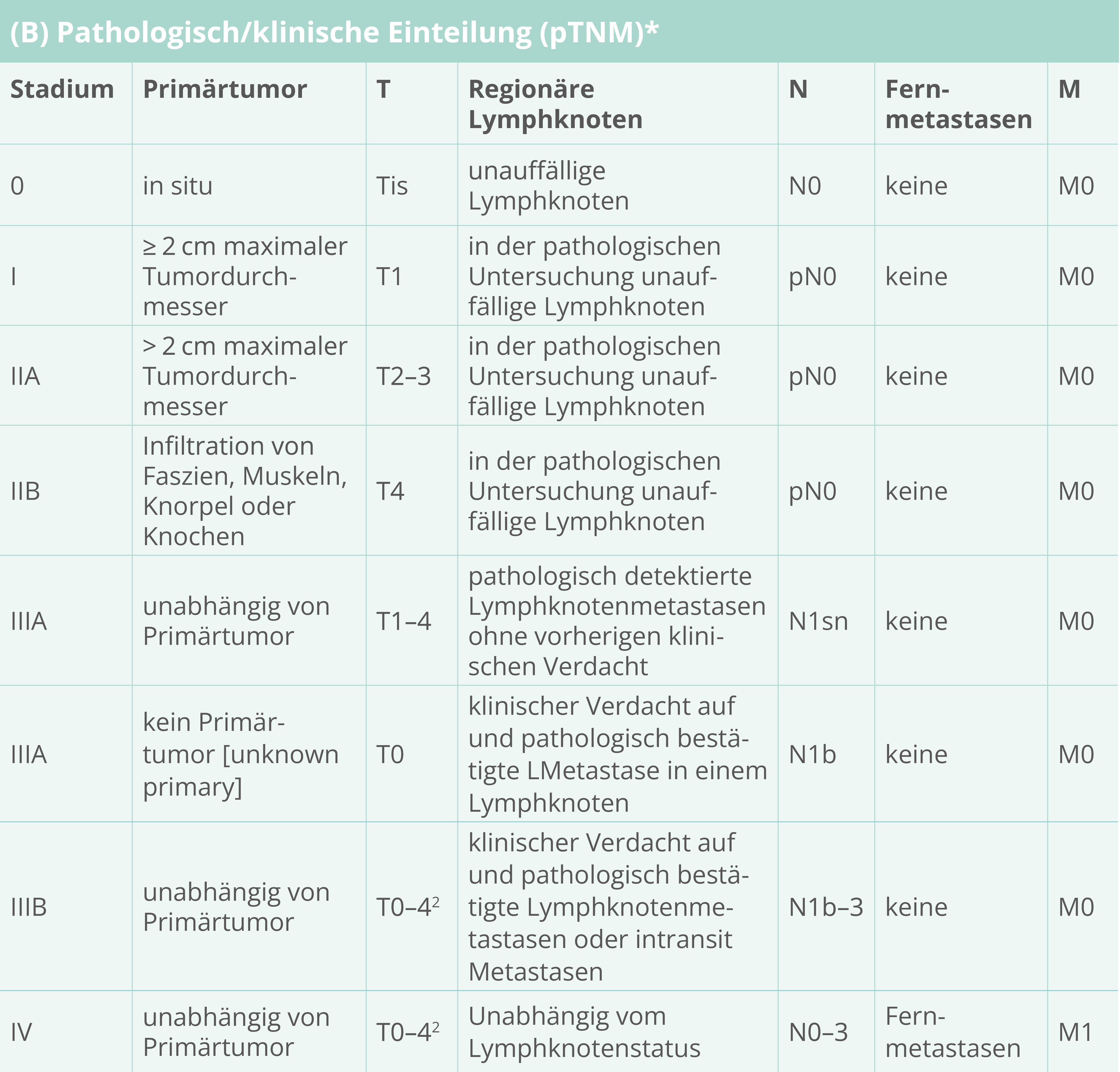
Stadieneinteilung des malignen Melanoms-pathologisch (AJCC 2016/ UICC 2016)
Das Uveamelanom betrifft Choroidea, Iris oder Ziliarkörper und ist eine seltene, aber aggressive Form des malignen Melanoms mit schlechter Prognose bei Metastasierung. Die Behandlung erfordert einen multidisziplinären Ansatz, sie umfasst Primärtherapie, molekulare Diagnostik, Nachsorge, medikamentöse Therapie und lebergerichtete Verfahren.
Primärtherapie
Abhängig von Größe, Ausbreitung und Lokalisation des Uveamelanoms
OP
Große Tumoren und solche mit skleraler oder extraskleraler Ausbreitung werden meist durch eine Enukleation behandelt oder mit Protonen bestrahlt.
Strahlentherapie
Kleinere Tumoren können mittels Brachytherapie oder Protonenbestrahlung behandelt werden. Strahlentherapeutische Verfahren zeigen ähnliche Abheilungsraten und haben gegenüber der Enukleation den Vorteil des Bulbuserhalts. Irismelanom: Risiken bei Strahlentherapie von Irismelanomen sind die im Verlauf mögliche Sekundärglaukombildung, Katarakt und ggf. erhöhte Blendungsempfindlichkeit. Kleinere Irismelanome können auch Augen-erhaltend reseziert werden.
Histologie und molekulargenetische Untersuchung
Diagnosesicherung: häufig kann ein Uveamelanom klinisch diagnostiziert werden, d. h. die Entnahme einer Probe zu Histologie und ggf. Molekulargenetik muss abgewogen werden, da
- Komplikationsrisiko wie z. B. Netzhautablösung, Blutungen oder Infektionen existiert.
- Molekulargenetische Untersuchungen nicht von allen Patienten gewünscht werden, z. B. Bestimmung des Chromosom 3-Status (Monosomie 3 vs. Disomie 3), Genexpressionsprofil (1). Diese Informationen sind u.a. entscheidend für die Prognose und die Planung der Nachsorge.
- Molekulargenetische Untersuchungen können ggf. im Falle einer
Medikamentöse Therapie
Eine Vorstellung in einer interdisziplinären Tumorkonferenz in einem spezialisierten Zentrum sollte zur Festlegung der Therapieoptionen erfolgen.
Klinische Studien
Für Patienten mit Uveamelanom ist die Teilnahme an klinischen Studien zu neuen Therapieansätzen eine wichtige Option.
Tebentafusp
Tebentafusp ist ein bispezifisches Fusionsprotein und die erste zugelassene systemische Therapie für HLA-A*02:01-positive Patienten mit inoperablem oder metastasiertem Uveamelanom, Verbesserung des Gesamtüberlebens in Studien.
Das Medikament wird intravenös verabreicht und erfordert eine sorgfältige Überwachung auf Nebenwirkungen, insbesondere auf das Zytokin-Freisetzungssyndrom (CRS) und Hautreaktionen.
Immuncheckpoint-Inhibitoren (ICIs)
ICIs wie Ipilimumab und Nivolumab können in Kombination oder als Einzeltherapie eingesetzt werden. Die Wirksamkeit von ICIs beim Uveamelanom ist jedoch im Vergleich zum kutanen Melanom geringer.
Andere Systemtherapien
Für Patienten, die nicht auf Tebentafusp oder ICIs ansprechen, können grundsätzlich weitere Therapieoptionen wie Chemotherapien, zielgerichtete Therapien (bislang keine Zulassung) oder zelluläre Immuntherapien überlegt werden. Ein Studieneinschluss ist hier anzustreben. Je nach Allgemeinzustand kann auch ein Vorgehen im Sinne von best supportive care sinnvoll sein.
Lebergerichtete Verfahren
Die Studienlage zu lokalen Leberverfahren ist begrenzt und die Ergebnisse sind uneinheitlich.
In einigen Studien zeigten lokale Leberverfahren eine Verbesserung des PFS und der Ansprechraten im Vergleich zur systemischen Therapie, aber keinen Vorteil im Gesamtüberleben.
Lokale Leberverfahren können bei Patienten mit metastasiertem Uveamelanom in Betracht gezogen werden, insbesondere wenn eine hohe Tumorlast in der Leber und kein oder geringer extrahepatischer Befall vorliegt.
Zu diesen Verfahren gehören:
Hepatische Chemosaturation/Chemoperfusion: Hierbei wird die Leber isoliert perfundiert, um eine hohe Konzentration an Chemotherapeutika direkt in den Tumor einzubringen.
Selektive Interne Radiotherapie (SIRT): Radioaktive Mikrosphären werden
über die Leberarterie in den Tumor injiziert.
Transarterielle Chemoembolisation (TACE): Eine Kombination aus Chemotherapeutika und Embolisationsmaterial wird in die Leberarterie injiziert, um den Tumor von der Blutversorgung abzuschneiden.
Radiofrequenzablation
Resektion: Die chirurgische Entfernung von Lebermetastasen ist nur bei isolierten Metastasen sinnvoll. Da die Leber bei Uveamelanomen oft diffus infiltriert ist, ist eine Resektion selten eine Option. Die Rezidivrate nach Resektion ist hoch.
Die Wahl des optimalen lokalen Leberverfahrens (z. B. Chemoperfusion vs. TACE vs. SIRT) hängt von verschiedenen Faktoren ab, wie der Größe und Lage der Metastasen, der Leberfunktion und dem Allgemeinzustand des Patienten.
Nachsorge
Die Nachsorge umfasst:
Augenärztliche Untersuchung: z. A. Lokalrezidiv
Lebersonographie: z. A. Lebermetastasen
Labor: Transaminasen, Cholestaseparameter, LDH und S100
Bei unklaren Befunden: MRT der Leber und weitere Schnittbildgebung
Die Empfehlungen richten sich idealerweise nach dem Risikoprofil des Tumors (siehe NCCN guidelines: uveal melanoma, von 01/2024 (3):
Hochrisikoprofil – T4 (AJCC) , Monosomie 3, BAP1 Mutation, Zugewinn Chromosom 8q, Genexpressionsprofil Klasse 2 nach (1): Untersuchungen alle 3–6 Monate in den ersten 5 Jahren, danach alle 6 –12 Monate bis Jahr 10, anschließend nach Klinik
Mittleres Risikoprofil – T2 und T3 (AJCC), SF3B1 Mutation, Genexpressionsprofil Klasse 1B nach (1): Untersuchungen alle 6 –12 Monate bis Jahr 10, anschließend nach Klinik
Niedriges Risiko – T1 (AJCC), Disomie 3, Zugewinn Chromosom 6p, EIF1AX Mutation, Genexpressionsprofil Klasse 1A nach (1): Untersuchungen alle 12 Monate bis Jahr 5 oder nach Klinik
Weitere Informationen
Adaptiert nach
- Onken MD, et al. Collaborative Ocular Oncology Group report number prospective validation of a multi-gene prognostic assay in uveal melanoma. Ophthalmology 2012;119:1596-1603.
- Hassel JC, Heppt MV: Uveamelanome, Die Onkologie 8/2023; 705-10.
- NCCN Guidelines Melanoma: Uveal; V1.2024; UM-4 ; https://www.nccn.org/login?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/uveal.pdf (abgerufen 06.01.2025)
Stadieneinteilung Aderhautmelanom nach AJCC 2018, 8. Edition.
Modifiziert nach Bechrakis NE et al. Uveal Melanoma – Standardised Procedure in Diagnosis, Therapy, and Surveillance. Klein Monbl Augenheilkd 2021; 238 (7): 761–772
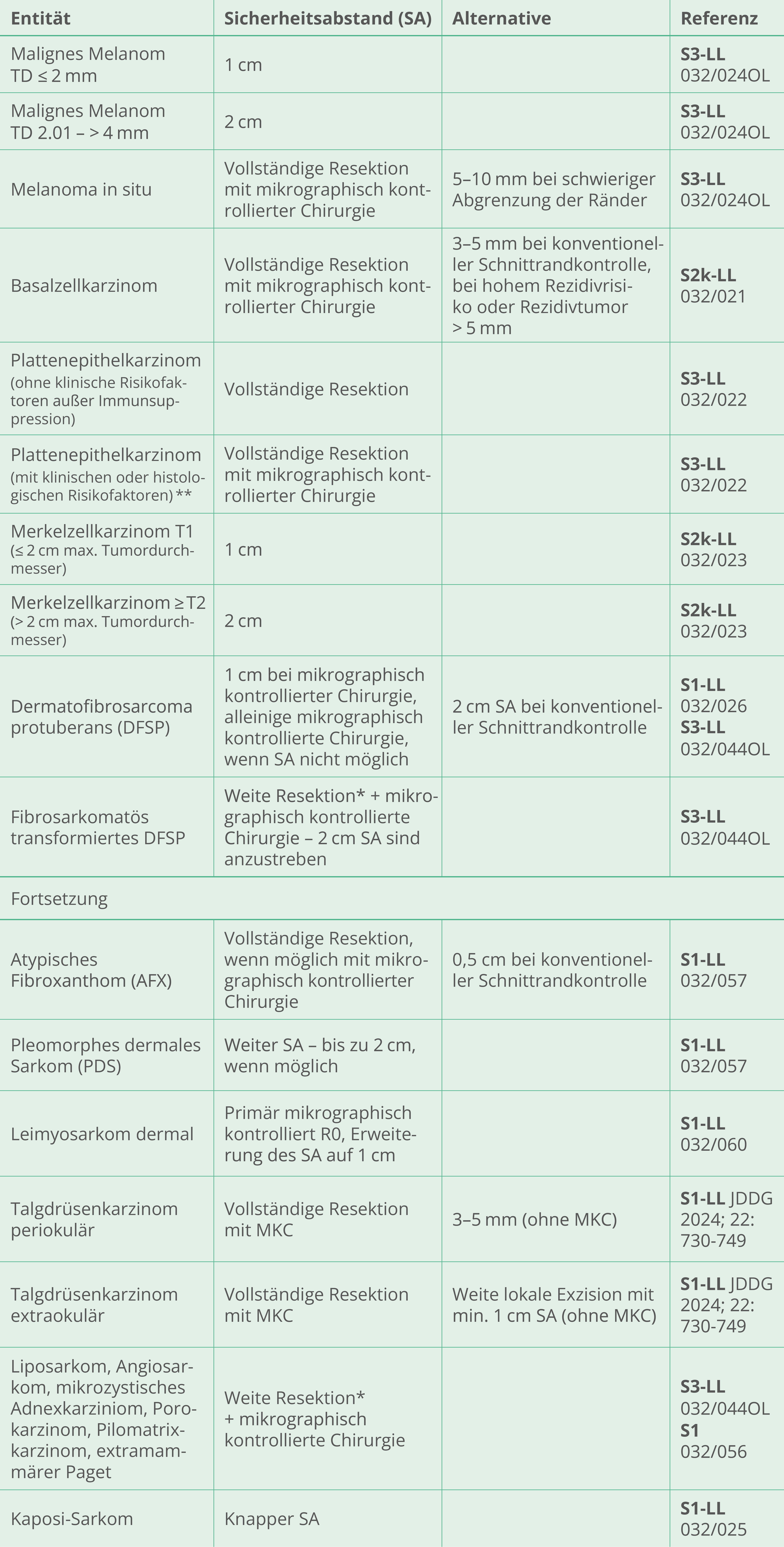
Das kutane Plattenepithelkarzinom ist nach dem Basalzellkarzinom der häufigste maligne Hauttumor. Es kann destruierend wachsen und metastasieren – initial häufig lymphogen.
OP
Vollständige Resektion, falls keine klinischen Risikofaktoren (Lokalisation an Ohr, Lippe, Schläfe, Lokalrezidiv, > 2 cm Durchmesser, keine Verschieblichkeit zum Untergrund)
Vollständige Resektion mit mikrographisch kontrollierter Chirurgie (MKC), falls klinische (s. o.) oder histologische Risikofaktoren (TD > 6mm Eindringtiefe, Desmoplasie, perineurale Invasion, Überschreiten der Subcutis, Differenzierung G3/G4)
Keine SLNB
Diagnostik (Bildgebung)
LK-Sono: bei Risikofaktoren (siehe oben)
Schnittbildgebung: bei V. a. Metastasierung
Strahlentherapie, postoperativ
R1- oder R2-Resektion, ohne Möglichkeit der Nachresektion
Ausgedehnter LK-Befall (> 1 LK +, LK-Metastase > 3 cm, Kapseldurchbruch, intraparotideale LK-Metastase)
Ausgedehnter Perineuralscheideninfiltration (PNI)
Ggf. bei knappem Resektionsrand
OP – Lokalrezidiv
Vollständige Resektion mit MKC
Strahlentherapie, postoperativ
R1- oder R2-Resektion, ohne Möglichkeit der Nachresektion
Ausgedehnter LK-Befall (> 1 LK +, LK-Metastase > 3 cm, Kapseldurchbruch, intraparotideale LK-Metastase)
Ausgedehnter Perineuralscheideninfiltration (PNI)
Strahlentherapie definitiv
Bei interdisziplinär festgelegter Inoperabilität
Falls keine OP und Strahlentherapie möglich
Prüfung Indikation Systemtherapie oder Elektrochemotherapie
Therapieentscheidung in Tumorkonferenz
Falls OP oder Strahlentherapie nicht möglich oder größere Funktionalitätseinbußen drohen: Systemtherapie mit
– Erstlinie mit zugelassenen PD-1-Inhibitoren
– 2nd line oder bei Kontraindikationen gg. PD-1-Inhibitoren: EGFR-Inhibitoren oder Chemotherapie
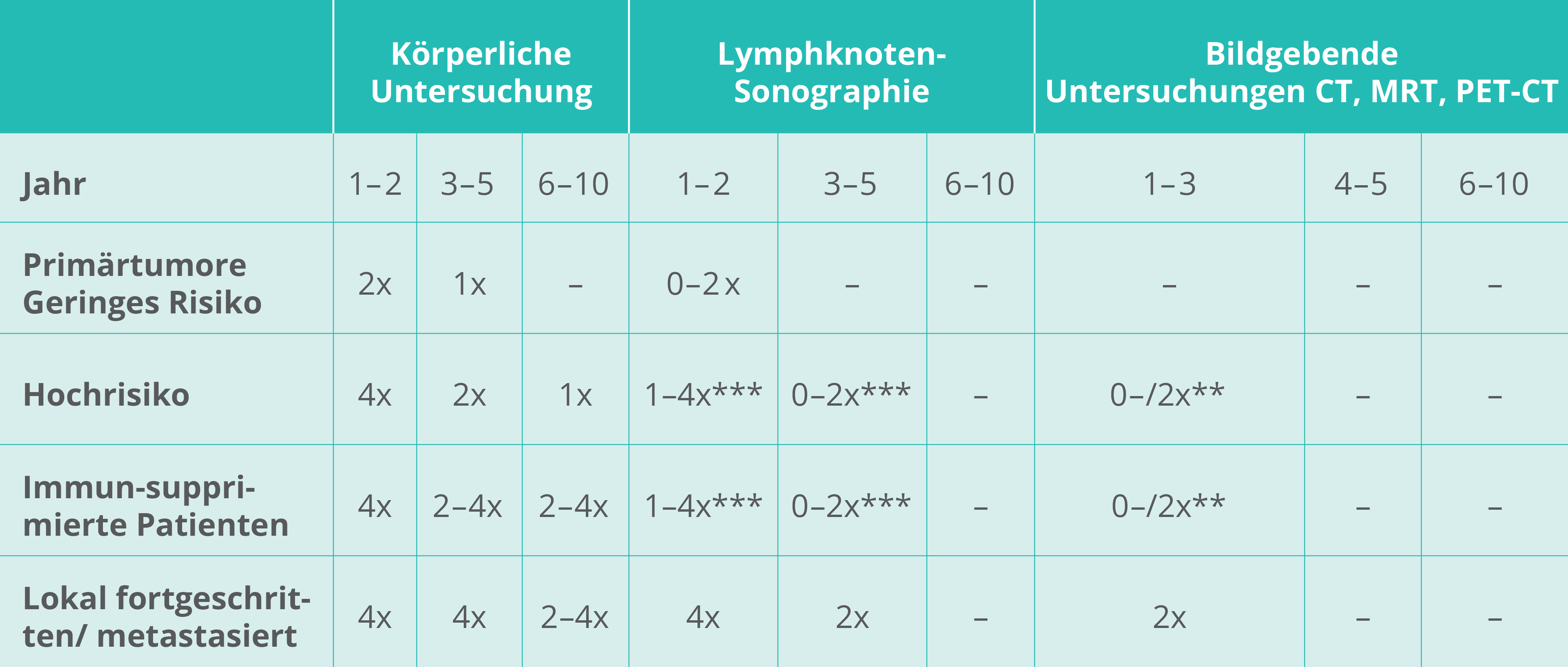
Nachsorge
* für R0-resezierte Stadien, Geringes Risiko: TD ≤ 6 mm, ≤ 4 mm bei Desmoplasie, G1–2 Differenzierung, Hohes Risiko, TD > 6 mm, > 4 mm bei Desmoplasi, G3–4 Differenzierung, perineurales Tumorwachstum, immunsupprimierte und Patienten mit Sekundärtumoren.
** bei perineuralem Tumorwachstum
*** in Abhängigkeit der Risikofaktoren
Weitere Informationen
Adaptiert nach S3-Leitlinie Aktinische Keratose und Plattenepithelkarzinom der Haut AWMF 032/022OL; https://register.awmf.org/assets/guidelines/032-022OLl_S3_Aktinische_Keratosen-Plattenepithelkarzinom-PEK_2023-01.pdf (abgerufen 20.12.2024)
* „tiefe Invasion“ ist definiert als Invasion jenseits des subkutanen Fettgewebes oder > 6 mm (gemessen vom Stratum granulosum der benachbarten Epidermis bis zur Basis des Tumors)
Eine perineurale Invasion als Kriterium für T3 ist definiert als klinische oder radiologische Beteiligung benannter Nerven ohne Beteiligung der Foramina oder der Schädelbasis.
* Das Vorhandensein einer Beteiligung (Invasion) der Haut oder der Weichteile oder klinische Zeichen einer Nervenbeteiligung wird als klinische extranodale Ausbreitung angesehen.
Die pT-Kategorien entsprechen den T-Kategorien. pM1 bedeutet, dass Fernmetastasen mikroskopisch bestätigt wurden.
Das Basalzellkarzinom der Haut ist der häufigste (semi-) maligne Tumor des Menschen in Mitteleuropa - mit steigender Inzidenz. Es wächst lokal infiltrierend und destruierend, eine Metastasierung ist sehr selten.
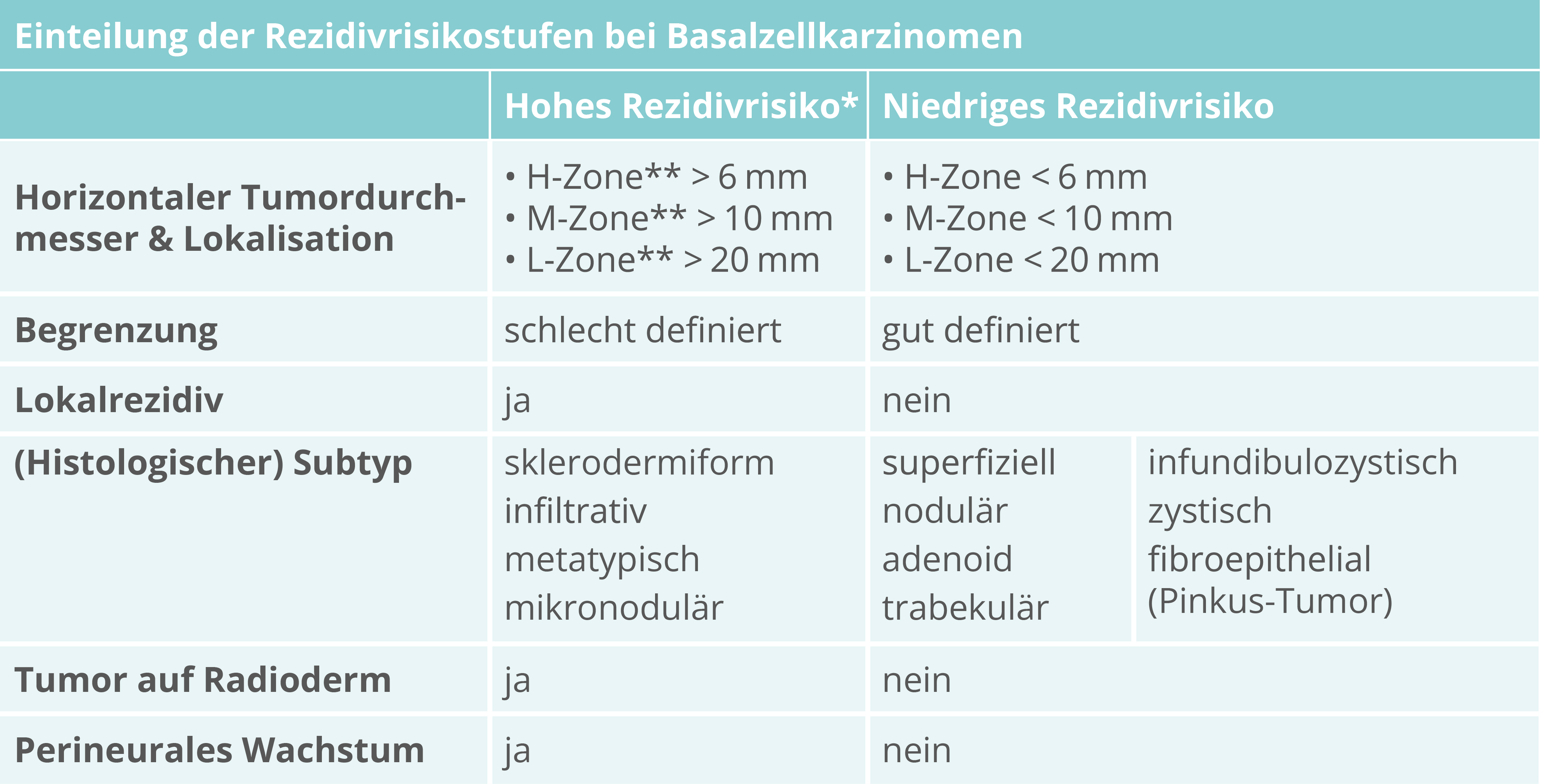
Rezidivrisiko
Bestimmung Rezidivrisiko (keine TNM-Klassifikation)
* Das Vorhandensein eines dieser Faktoren führt zur Einstufung in diese Kategorie
** H-Zone: „zentrales“ Gesicht – Augenlider, Augenbrauen, periorbital, Nase, Oberlippe, Kieferwinkelregion, prä- und postaurikulär, Ohren, Schläfen, Genitale, Hände, Füße
M-Zone: Wangen, Stirn, Kinn, Unterlippe, Kapillitium, Hals, prätibial
L-Zone: Rumpf, Extremitäten
OP
Therapie der ersten Wahl
Sicherheitsabstand (SA): Bei mikroskopisch kontrollierter Chirurgie kein SA empfohlen; Nachexzision bis R0
3–5 mm SA bei niedrigem Rezidivrisiko und konventioneller Histologie
> 5 mm SA bei Rezidivtumoren oder hohem Rezidivrisiko, wenn keine mikrographisch kontrollierte Chirurgie möglich ist.
Bei superfiziellen BZK Horizontalexzision (Shave-Exzision) möglich.
Falls R1 und keine Nachexzision möglich: nicht operative Verfahren
Bei konventioneller Exzision ohne Randschnittkontrollen Vorgehen siehe Abbildung auf der rechten Seite
Therapiealgoritmus Basalzellkarzinom (BZK)
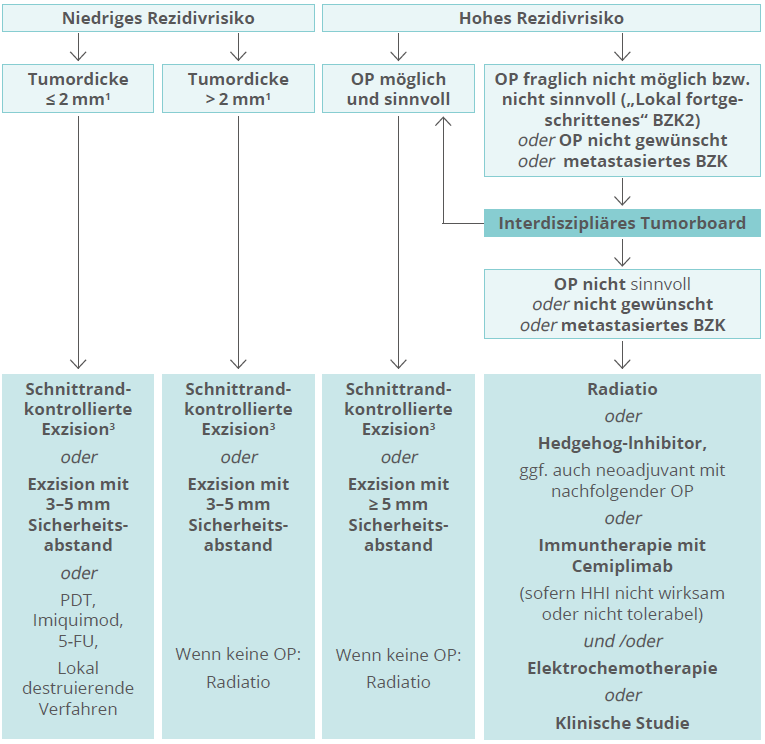
Fett gedruckt: starke Empfehlung; normal gedruckt: abgeschwächte bzw. offene Empfehlung
- 1. Der Grenzwert der Tumordicke ist nicht hinreichend evidenzbelegt und beruht auf interdisziplinärer Konsentierung. Daher ist dieser Grenzwert als Orientierung und nicht als feststehende Größe zu verstehen.
- Unter „lokal-fortgeschrittenen“ Basalzellkarzinomen versteht man eine Untergruppe von Tumoren, die aufgrund ihrer Ausdehnung und insbesondere ihres destruierenden Tiefenwachstums eines interdisziplinären Therapiekonzepts bedürfen.
- Die Schnittrand-kontrollierte Exzision wird - sofern diese möglich ist - grundsätzlich als Therapie der ersten Wahl angesehen.
Topische Therapie/Kryo/Laser
Imiquimod 5 %, 5-Fluorouracil:
Superfizielle BZK bei Kontraindikationen (KI) gegen OP
PDT mit 5-ALA oder MAL:
bei dünnen BZK, vorzugsweise bei KI gegen OP
Kryochirurgie:
kleine superfizielle BZK an Rumpf oder Extremitäten bei KI gegen OP oder topische Verfahren
Ablative (CO2, Er:YAG) und nicht-ablative (Farbstoff, Nd:YAG) Laser: Niedrigrisiko-BZK bei KI gegen Operation oder topische Verfahren
Strahlentherapie
Definitiv: bei Kontraindikationen gegen OP oder OP nicht gewünscht
Postoperativ: R1 und Nachexzision nicht möglich oder Perineuralscheideninfiltration (Pn1)
Diagnostik (Bildgebung)
laBZK (locally advanced):
Bei V. a. Knocheninfiltration CT und/oder MRT mit KM
Lokalisation Orbita
Bei V. a. Orbitainfiltration CT und/oder MRT mit KM
Perineurales Wachstum: MRT
Metastasiertes BZK (mBZK): Schnittbildgebung
Strahlentherapie
Indikationen:
- Inoperabilität bei laBZK (als individuelle Entscheidung über Tumorkonferenz)
- Postoperative Radiatio bei R1 oder Perineuralscheideninfiltration (Pn1)
Keine Radiatio bei hohem Risiko für eine Zweittumorinduktion
(Alter < 40 Jahre, Patienten mit BZK-Syndrom, Kollagenosen, Lupus erythematodes, Sklerodermie)
Medikamentöse Therapie
Diskussion im Tumorboard, ob OP, Strahlentherapie, Elektrochemotherapie
oder systemische Therapie (Hedgehog-Inhibitoren, anti-PD-1) oder Studie.
Falls Systemtherapie:
– laBZK oder mBZK: Sonidegib oder Vismodegib
– BZK-Syndrom und multiple BZK: Sonidegib oder Vismodegib
2nd line: Immuncheckpointtherapie mit anti-PD-1
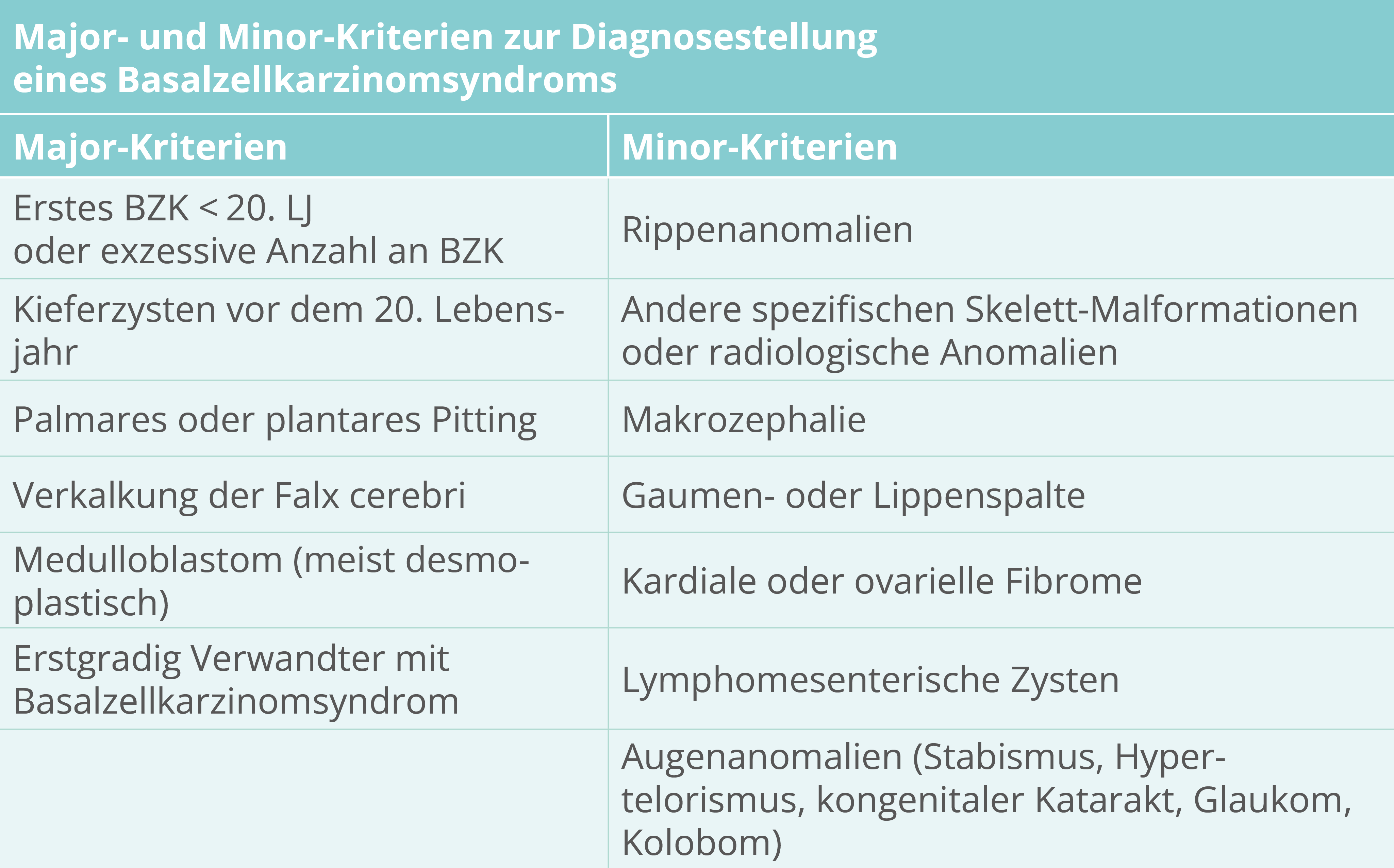
BZK-Syndrom
BZK vor dem 20. LJ: genetische Abklärung BZK-Syndrom
V.a. BZK-Syndrom: MRTs zum Ausschluss weiterer Malignome und Nachweis assoziierter Fehlbildungen
Weitere Informationen
Adaptiert nach S2k-Leitlinie Basalzellkarzinome der Haut Version 9.0 AWMF 032/021;
https://register.awmf.org/assets/guidelines/032-021l_S2k_Basalzellkarzinomder-Haut_2024-07.pdf (abgerufen 20.12.2024)
Das Merkelzellkarzinom ist ein seltener, maligner Hauttumor mit epithelialer und neuroendokriner Differenzierung. Lokalrezidive und eine lymphogene Metastasierung sind häufig.
OP/Sicherheitsabstand
Stadium I (Durchmesser Tumor ≤ 2 cm): SA 1 cm
Stadium II (Durchmesser Tumor > 2 cm): SA 2 cm
Diagnostik (SLNB, Bildgebung)
Bildgebung vor SLNB: LK-Sono und Schnittbildgebung, wenn möglich PET/MRT oder 18F-FDG PET/CT
SLNB: empfohlen, wenn in der Bildgebung keine Metastasierung (N0/M0).
Alternative zur SLNB im Kopf/Halsbereich: funktionelle neck dissection.
Strahlentherapie
Adjuvante Nachbestrahlung des Tumorareals empfohlen. Falls keine SLNB wegen hohem OP-Risiko erfolgt ist: Tumorareal plus Lymphabflußregion
TLND/Strahlentherapie
Positiver SLNB (Mikrometastasen): Komplettierende Lymphknotendissektion (CLND) und/oder Radiatio der betroffenen Region
LK-Makrometastasen und M0: TLND oder eine Radiatio der betroffenen Region. Bei erhöhtem Rezidivrisiko (z. B. Kapseldurchbruch) auch eine Kombination von TLND & Radiatio
Strahlentherapie
Gute Strahlensensitivität; Indikationen zur Radiatio in allen Stadien der Erkrankung, bei Fernmetastasen im Rahmen eines multimodalen Konzeptes neben Chemo-/Immuntherapie oder alleinig mit (in der Regel) palliativer Intention.
Systemtherapie
EMA-Zulassung für PD-L1 AK Avelumab und PD-1 AK Retifanlimab. Retifanlimab ist aktuell in Deutschland nicht erhältlich (Stand 01/2025). Ansprechraten der Therapie mit Nivolumab, Pembrolizumab vielversprechend aber bisher keine Zulassung, bei Progress unter Monotherapie PD-L1 oder PD-1 Blockade kann Ipilimumab + Nivolumab in Betracht gezogen werden. T-VEC intraläsional ist möglich (Fallberichte).
Chemotherapie: chemosensitiver Tumor, allerdings rasche Resistenzentwicklung. In der Zweitlinie Anthrazykline, Antimetabolite, Cyclophosphamid, Etoposid, und Platinderivate (Monotherapie oder in Zweifach- bzw. seltener Dreifachkombination).
Nachsorge
Stadium I und II: Jahr 1+2 klinische Untersuchungen in 3-monatigen Abständen, Jahr 3–5 in 6-monatigen Abständen. Zusätzlich LK-Sono.
Stadium III oder unklarer SLNB-Staus: engmaschige Schnittbildgebung (18-FDG PET/CT oder Kombination aus Sono, CT und MRT)
Weitere Informationen
Adaptiert nach S2k-Leitlinie Merkelzellkarzinom (MCC) AWMF 032/023;
https://register.awmf.org/assets/guidelines/032-023l_S2k_Merkelzellkarziom-MZK-MCC-neuroendokrines-Karzinom-der-Haut_2023-04.pdf (abgerufen 19.12.2024)
* Stadieneinteilung nach TNM-Klassifikation der AJCC (8. Edition 2017)
1. Der Befund basiert rein auf einer klinischen bzw. bildgebenden Untersuchung; diese kann Inspektion, Palpation und/oder Bildgebung beinhalten
2. T0: Kein Nachweis eines Primärtumors; TX: Primärtumor kann nicht beurteilt werden (z. B. kürettiert)
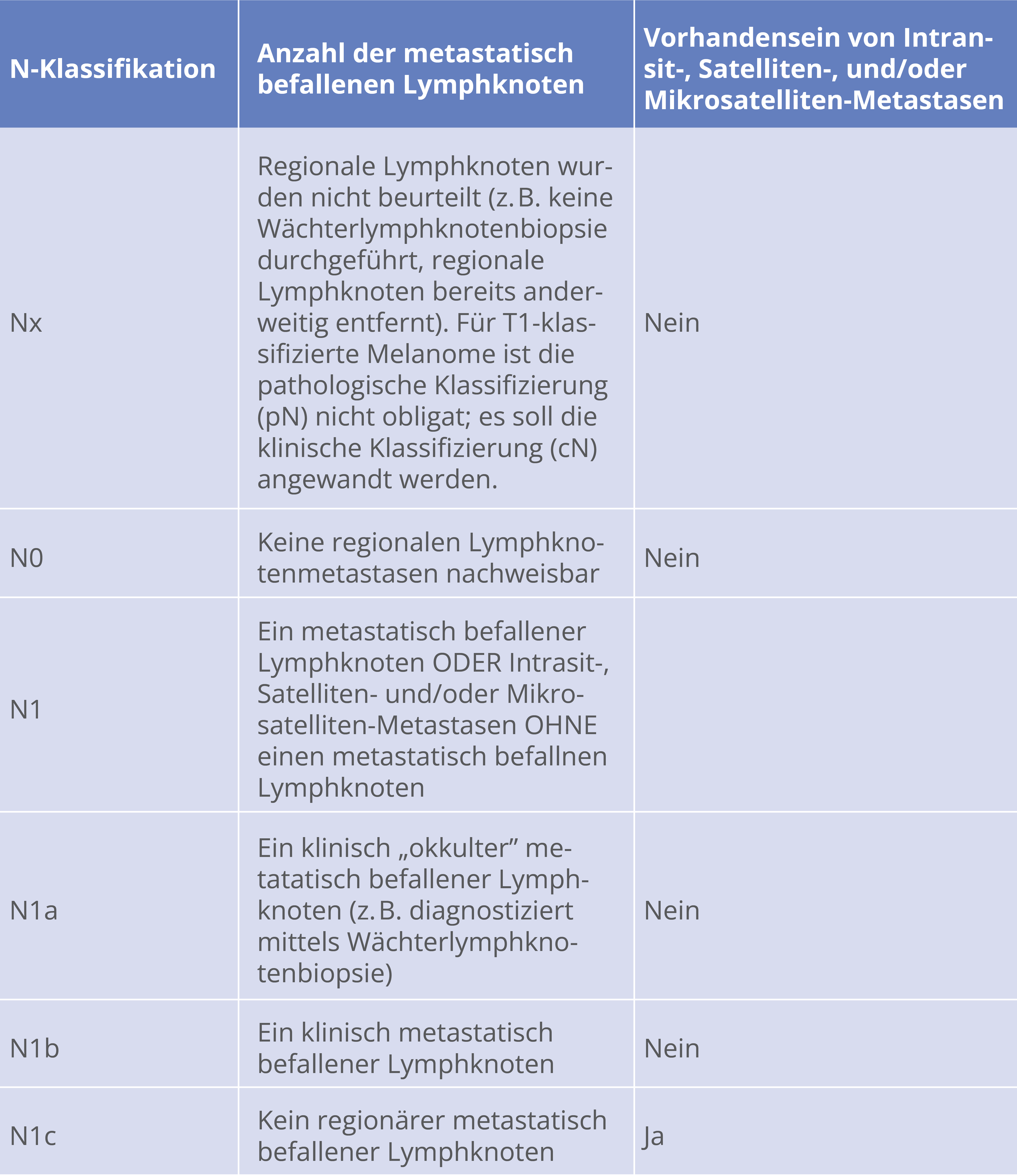
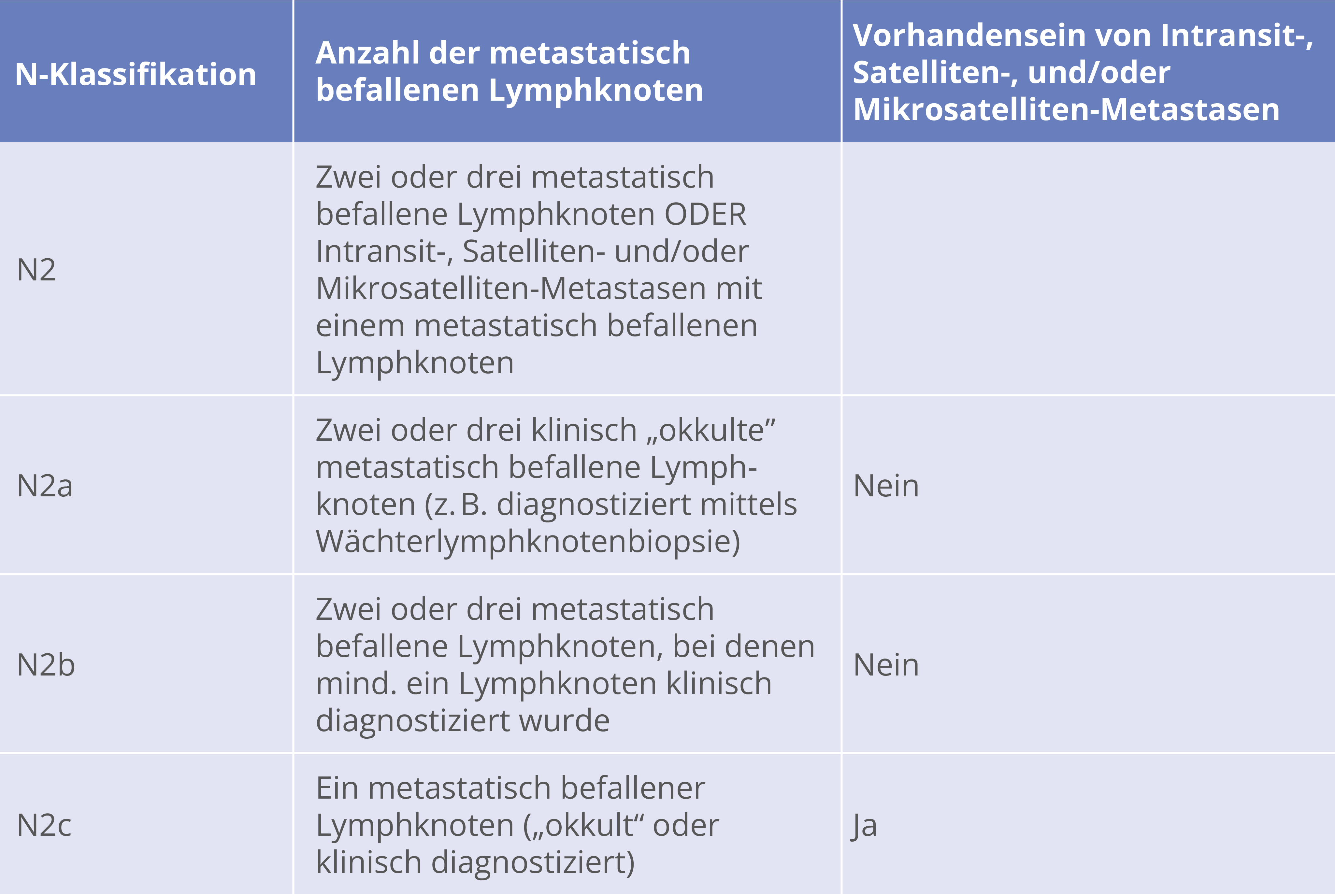
3. Mikrometastasen wurden nach einer Schildwächterlymphknotenbiopsie oder nach elektiver Lymphadenektomie histopathologisch ausgeschlossen
Das Dermatofibrosarcoma protuberans ist ein seltener Hauttumor, der sehr langsam lokal aggressiv und infiltrierend wächst. Lokalrezidive sind häufig, eine Metastasierung sehr selten.
OP/Sicherheitsabstand
SA 1 cm – bei dreidimensionaler mikrographischer Schnittrandkontrolle
SA min. 2 cm – bei konventioneller histologischer Schnittrandkontrolle Cave: Bei fibrosarkomatös transformierten DFSP operative Therapie nach Leitlinie der high-grade Weichgewebssarkome Sicherheitsabstand min. 2 cm und Anbindung an ein Sarkomzentrum.
Diagnostik (Bildgebung)
Primär operable DFSP: keine Bildgebung Lokalrezidiv und/oder Verdacht auf Metastasierung: LK-Sono + CT oder MRT
Postop. adjuvante Therapie
Bei R0-Befunden keine adjuvante Nachbestrahlung des Tumorareals, bei R1-Befund postop. Nachbestrahlung empfohlen (60–66 Gy)
Strahlentherapie
Gute Strahlensensitivität; Indikationen: primäre Inoperabilität, R1- oder R2-Resektion, Zustand nach mehrfachen Rezidiven; Strahlengesamtdosis 60-66 Gy (R1) bzw. 66–70 Gy (R2) unter kurativer Zielsetzung.
Medikamentöse Therapie
EMA-Zulassung für Imatinib 400 bis 800 mg/d bei inoperablen lokal fortgeschrittenen oder metastasierten DFSP mit Ansprechrate um 50 %; bei Resistenz gegen Imatinib können andere PDGF-R Inhibitoren zum Einsatz kommen (z. B. Sunitinib).
Chemotherapie: geringe Wirksamkeit; nicht empfohlen.
Immuntherapie/Checkpoint-Inhibitoren: keine Studiendaten vorliegend.
Nachsorge
Primärtumorstadium:
klinische Untersuchungen in halbjährlichen Abständen für mindestens fünf Jahre (frühzeitige Erfassung von Lokalrezidiven oder LK-Metastasen).
Stadium der Metastasierung, sehr ausgedehnte Tumoren:
klinische und apparative Untersuchungen (Lymphknoten-Sonographie oder Schnittbildgebung) in dreimonatlichen Abständen für zwei Jahre, danach in halbjährlichen Abständen für mindestens drei Jahre.
Fibrosarkomatös transformierte DFSP:
Nachsorge über Sarkomzentrum analog high grade Weichgewebssarkomen.
Weitere Informationen
Adaptiert nach S1-Leitlinie AWMF-032/026; https://register.awmf.org/assets/guidelines/032-026l_S1_Dermatofibrosarcomaprotuberans-DFSP_2019-04-abgelaufen.pdf (abgerufen 20.12.2024)
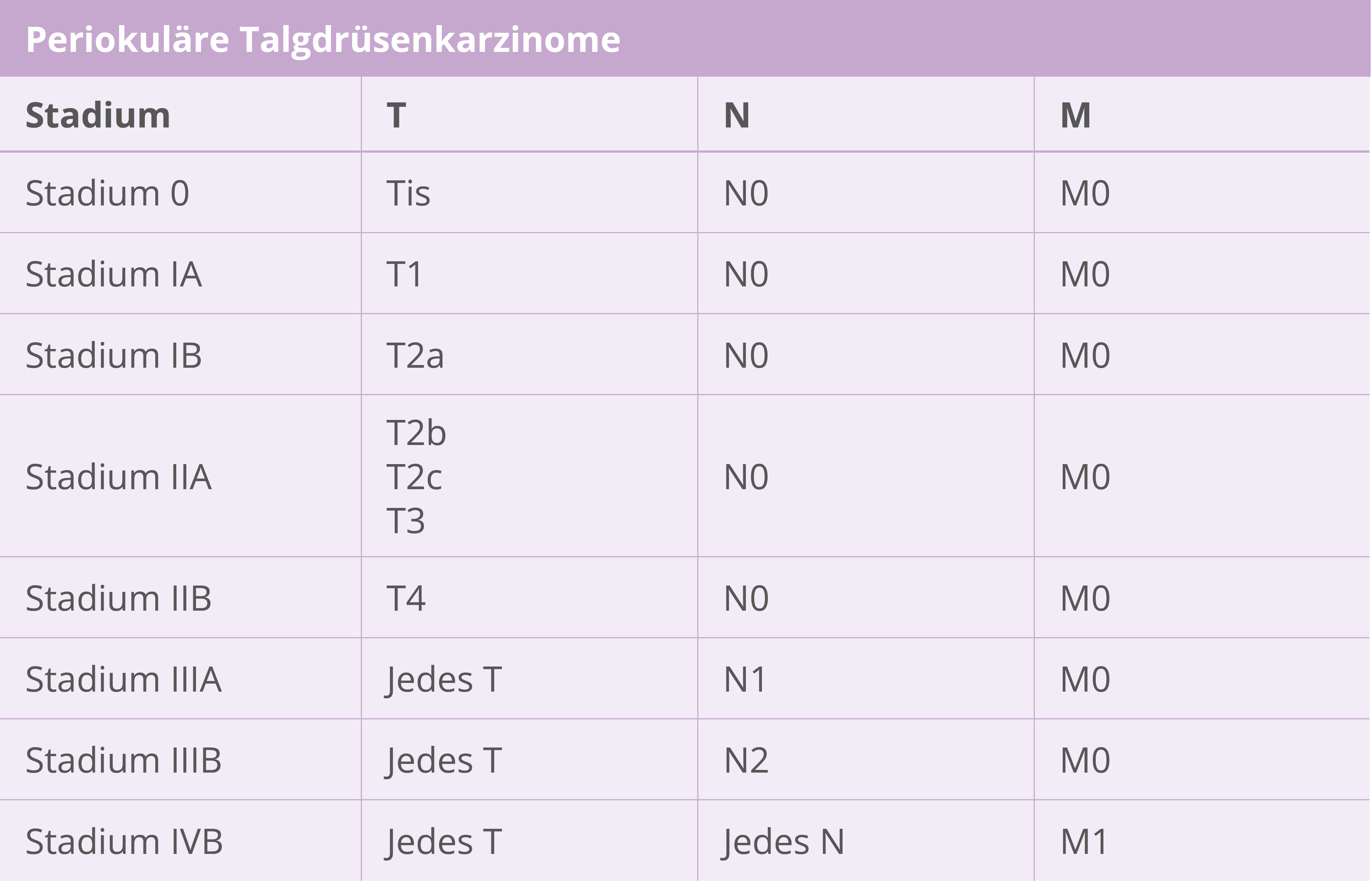
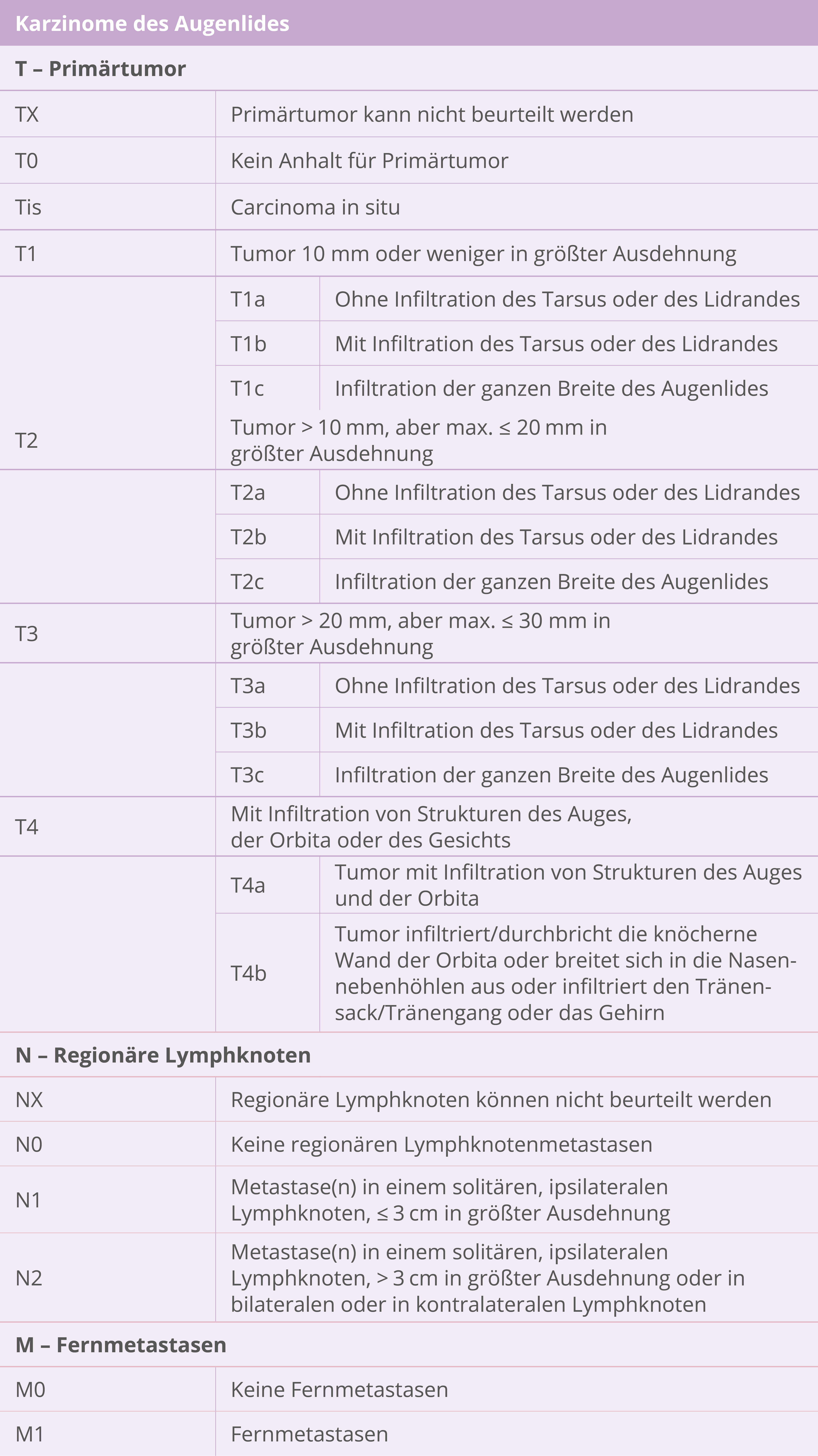
Seltener maligner kutaner Adnextumor mit einem Prädilektionsbereich in der Kopf-Halsregion. Eine lymphogene Metastasierung ist insbesondere bei periokulären Talgdrüsenkarzinomen nicht selten.
Diagnostik
Ganzkörperinspektion
Klinische Untersuchung der Lymphknotenstation
Periokulär: Vorstellung Augenarzt
OP
Sicherheitsabstand (SA): Bei mikroskopisch kontrollierter Chirurgie (MKC)
kein SA empfohlen
Periokulär ohne MKC: 3–5 mm SA
Extraokulär ohne MKC: weite lokale Exzision mit mindestens 1 cm SA
Falls peri/extra-okuläres Talgdrüsenkarzinom mit pagetoider/flächenhafter Ausbreitung: Tumorkonferenz, ggf. Ausbreitungsdiagnostik mit Mappingbiopsien
SLNB
Diskussion und individuelle Entscheidung im Tumorboard empfohlen. Prognostische und therapeutische Relevanz unklar. Metastasierung in regionäre Lymphknoten relativ selten (periokulär 15 %, extraokulär < 1 %)
Periokulär: kann bei Tumoren ≥ T2c (Infiltration der ganzen Breite des Lidrandes) erwogen werden
Extraokulär: kann bei Risikofaktoren (Lokalisation Lippe, Ohr, ≥ T2c, schlechte Differenzierung, pagetoides Wachstum, perineurale Invasion, Immunsuppression) erwogen werden
CLND /TLND
Diskussion und individuelle Entscheidung im Tumorboard empfohlen.
Periokulär und SLN +: CLND, Tuko
Extraokulär und SLN +: keine CLND, TuKo
Bei klinischem Verdacht auf LK-Metastasierung: TLND – Tuko
Diagnostik (Bildgebung)
Regionäre LK-Stationen: mittels Sono oder Schnittbildgebung nicht routinemäßig, nur bei rezidivierenden Talgdrüsenkarzinomen, ausgedehnten
Tumoren und V.a. Metastasierung sowie bei Periokulär ≥ T2c, schlechter Differenzierung, pagetoidem Wachstum, perineuraler Invasion
Potentielle Fernmetastasen: mittels Schnittbildgebung nur bei LK Metastasen
Strahlentherapie
Therapeutisch 56 –70Gy, adjuvant 45 – 60Gy.
Extraokulär: Indikationen Inoperabilität, Ablehnung der OP oder palliative Situation
Extraokulär adjuvant: nach individueller Abwägung bei lokal fortgeschrittenen Tumoren, R1/R2, knapper SA < 5 mm, PNI, Lokalrezidiv, bei Z. n. LK Metastasen
Periokulär: Indikationen Inoperabilität, Rezidiv, Option bei extensiver
orbitaler Beteiligung, Tumoren < 10 mm
Periokulär adjuvant: Nutzen nicht geklärt, ggf. bei R1, Rezidiv, geringe Differenzierung, PNI
CAVE: bei Oberlidbestrahlung relevante okuläre Toxizität, ggf. Hochdosisbrachytherapie als Boost plus ERBT (external beam radiation therapy) erwägen
Periokulär und SLN+: ggf. Alternative zur CLND
LK-Metastasen: Radiatio nach TLND erwägen
Palliativ: mögliche Option
Lokaltherapie
Periokulär mit pagetoider oder intraepithelialer Ausbreitung: als Monotherapie oder in Kombination mit OP mittels Kryochirurgie und/oder Mitomycin lokal
Medikamentöse Therapie
Lokal fortgeschrittene oder metastasierte Talgdrüsen-CA: konventionelle Protokolle mit Chemotherapie (z. B. 5-FU + platinbasiert) nur Fallserien, auch neoadjuvante Konzepte beschrieben
Vielversprechende Option: PD-1-Inhibitoren (v.a. extraokuläre Tumore), Trastuzumab (wenn HER2 nachweisbar)
Ggf. Molekulare Diagnostik für potentielle Ansatzpunkte zielgerichtete Therapie: RAR-β, Androgen-Rezeptor, mTOR, EGFR, HER2, Pi3K
Nachsorge
Lokalrezidive häufig (> 10 %), dann in 5,5 – 6,7 % auch mit Fernmetastasen.
Muir-Torre-Syndrom
Falls ≥ 2 Punkte beim Risikoscore vorliegen: genetische Diagnostik
Der Gesamtscore ergibt sich aus der Addition der Punkte, die für die vier Score-Variablen erhoben wurden. Folglich können sich Gesamtscore-Werte zwischen 0–5 ergeben. Ein Score von ≥ 2 hat eine Sensitivität von 100 % und eine Spezifität von 81% für die Prädiktion einer Keimbahnmutation in einem der Lynch-Syndrom-Mismatch-Repair-Gene.
a Als sebozytäre Neoplasien werden Talgdrüsenadenome, Talgdrüsenepitheliome, Keratoakanthome sowie Talgdrüsenkarzinome gewertet. Talgdrüsenhyperplasien werden nicht als MTS assoziiert angesehen.
Ein Patient nur mit Talgdrüsenhyperplasien erhält hier folglich keinen Punkt.
b Zu den Lynch-Syndrom-assoziierten Malignomen werden kolorektale Karzinome, Endometriumkarzinome, Ovarialkarzinome, Magenkarzinome, Dünndarmkarzinome, Urothelkarzinome (Nierenbecken/Ureter) und Gallengangskarzinome gezählt.
Weitere Informationen
Adaptiert nach S1-Leitlinie Talgdrüsenkarzinom AWMF 032-061; https://onlinelibrary.wiley.com/doi/pdf/10.1111/ddg.15405_g (abgerufen 20.12.2024)
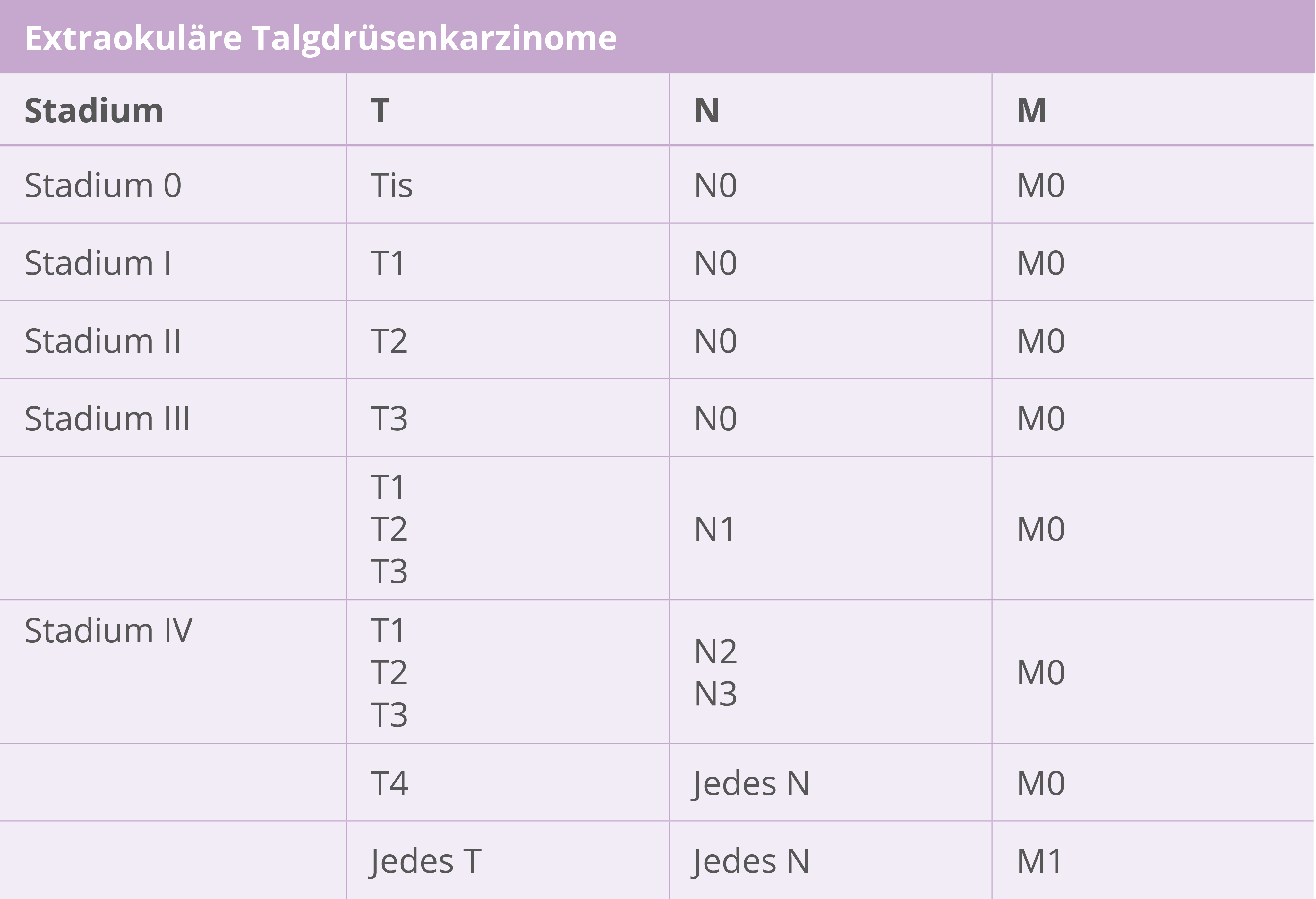
Stadieneinteilung
TNM-Klassifikation
Stadieneinteilung
Das atypische Fibroxanthom (AFX) und das pleomorphe dermale Sarkom (PDS) sind seltene Neoplasien der Haut und histomorphologisch, genetisch sowie epigenetisch Varianten eines Tumorspektrums.
OP/Sicherheitsabstand
AFX: vollständige Resektion (möglichst dreidimensionale mikrographische Schnittrandkontrolle)
PDS: weiter SA – bis zu 2 cm, wenn anatomisch/funktionell/ästhetisch möglich
Diagnostik (Bildgebung)
AFX: keine
PDS: LK-Sono
– bei unverschieblichen Tumoren oder V. a. tiefe Infiltration lokoregionäre Schnittbildgebung
Adjuvante Strahlentherapie (R0)
AFX: nein
PDS: bei Exzisionen ohne Sicherheitsabstand zu erwägen
Strahlentherapie
Bei Inoperabilität/unvollständiger Tumorexzision kann eine Nachbestrahlung des Tumorareals erwogen werden
Medikamentöse Therapie
Inoperable oder metastasierte PDS: individuelle Therapieentscheidung; Therapie mit einem Checkpoint-Inhibitor erscheint eine vielversprechende Option (off-label)
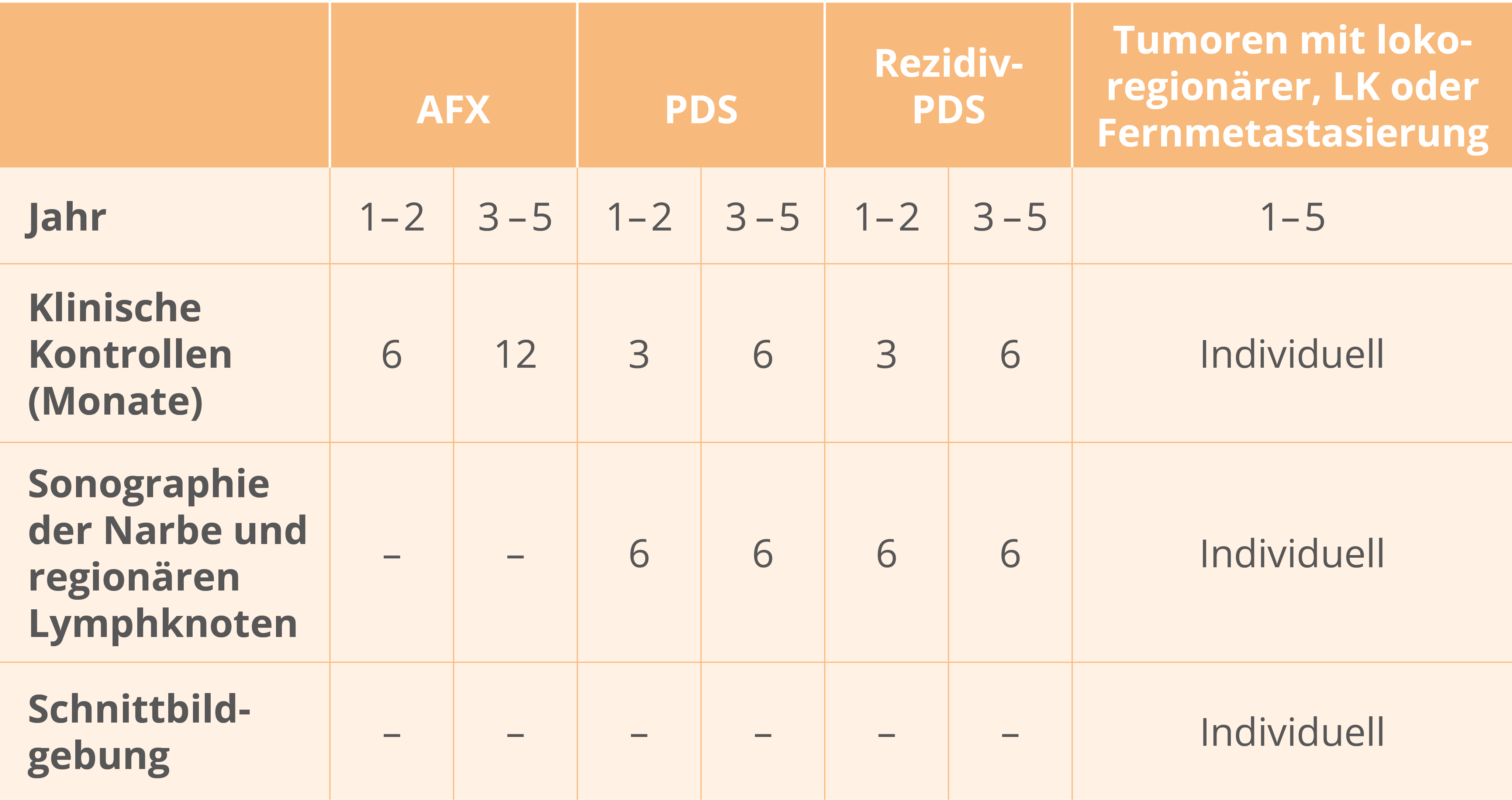
Nachsorge
AFX: klinische Untersuchungen halbjährlich
PDS: klinische Untersuchungen 3-monatlich innerhalb der ersten beiden Jahre, danach jährlich und entsprechend halbjährlich für mindestens fünf Jahre empfehlenswert (inklusive Palpation und Sonographie der lokoregionalen Lymphknoten). Apparative Untersuchungen wie Schnittbildgebung erscheinen lediglich bei Auffälligkeiten, bei Primärtumoren mit Besonderheiten (Gefäßeinbruch), Rezidiven oder bereits metastasierten Tumoren indiziert.
Weitere Informationen
Adaptiert nach S1-Leitlinie Atypisches Fibroxanthom (AFX) und pleomorphes dermales Sarkom (PDS) AWMF 032/057; https://register.awmf.org/assets/guidelines/032-057l_S1_Atypisches-Fibroxanthom-AFX-pleomorphes-dermales-Sarkom__PDS__2022-01.pdf (abgerufen 20.12.2024)
Das kutane Angiosarkom ist ein seltener, aggressiver, maligner Tumor, der von den Endothelzellen der Blutgefäße ausgeht. Das kutane Angiosarkom breitet sich lokal schnell aus und metastasiert häufig in Lymphknoten und innere Organe.
- Klassisches, idiopathisches Angiosarkom bei älteren Menschen
- Lymphödem-assoziiertes Angiosarkom
- Strahleninduziertes Angiosarkom
- Epitheloides Angiosarkom
OP
Primäre Exzision mit Zielsetzung R0 (mikrographisch kontrolliert) unter Funktionserhalt. Verzögerungen der nachfolgenden Radiotherapie vermeiden.
Alternative Massenreduktion (R1) und adjuvante Radiatio oder primäre Radiochemotherapie.
Diagnostik (Bildgebung)
Individualisiert: Lymphknotensonographie, CT oder MRT, alternativ PET-CT (für Zusatzinformation inkl. Ausdehnung im Weichteilmantel der Haut zur OP-Planung)
Strahlentherapie (adjuvant)
Postoperative Radiatio am Primärort mit individualisiert angemessener Sicherheitszone empfohlen.
Medikamentöse Therapie
Primäre Radiochemotherapie oder Anthrazykline und Taxane, Immuncheckpointinhibitoren (Fallberichte)
Elektrochemotherapie
Palliativer Ansatz zur lokalen Kontrolle
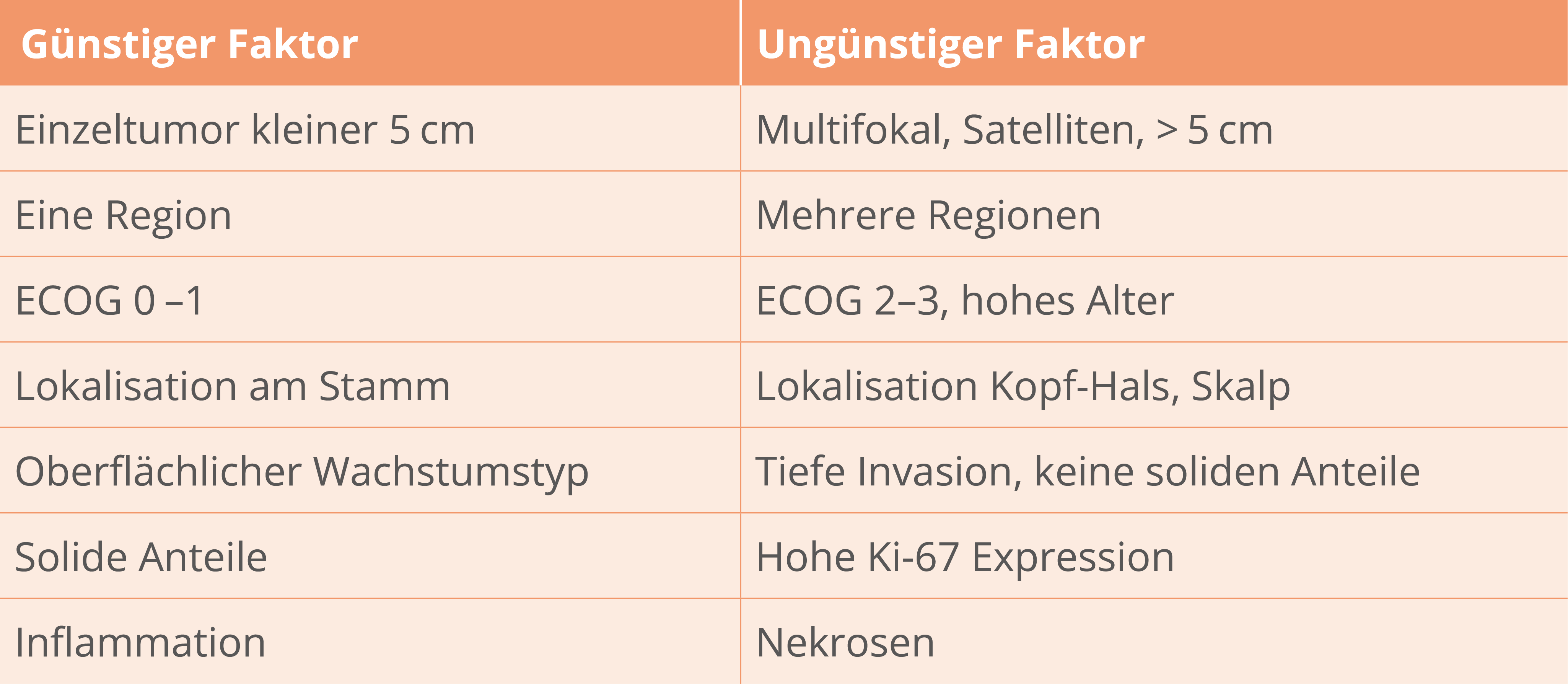
Prognosefaktoren
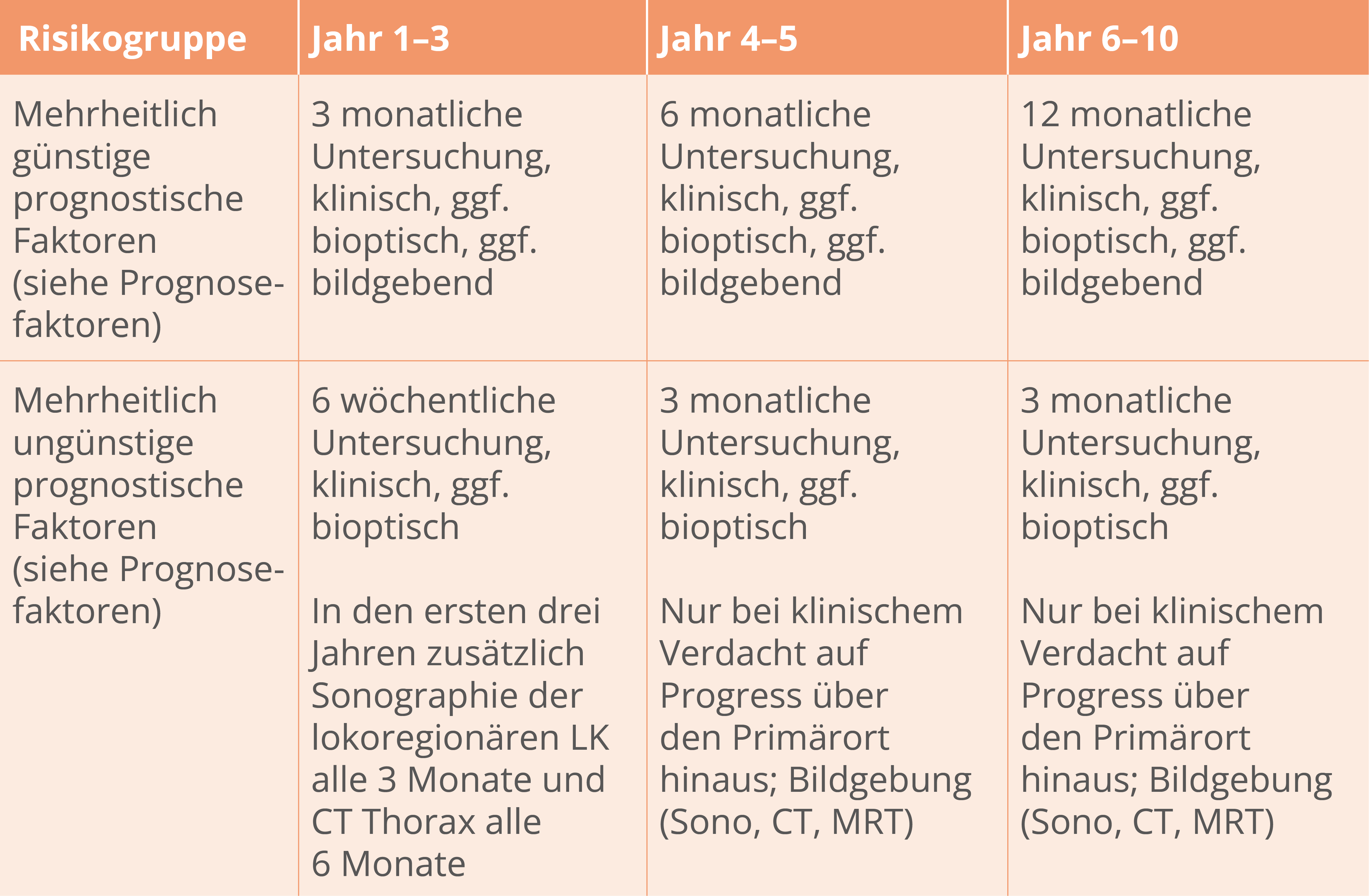
Nachsorge
Weitere Informationen
Adaptiert nach S1-Leitlinie Kutane Angiosarkome AWMF 032/056; https://register.awmf.org/assets/guidelines/032-056l_S1_Kutane-Angiosarkome__2021-03.pdf (abgerufen 20.12.2024)
Das Kaposi-Sarkom ist eine seltene maligne endotheliale Neoplasie primär in der Haut oder Schleimhaut, sekundär ggf. in inneren Organen. Das Kaposi-Sarkom kann spontan oder unter Immunsuppression auftreten.
Subtypen des Kaposi-Sarkoms (KS)
Klassisches, sporadisches KS
KS bei iatrogener Immunsuppression
Endemisches, afrikanisches KS
Epidemisches HIV-assoziiertes KS
KS bei Männern, die Sex mit Männern haben, (MSM) ohne HIV Infektion.
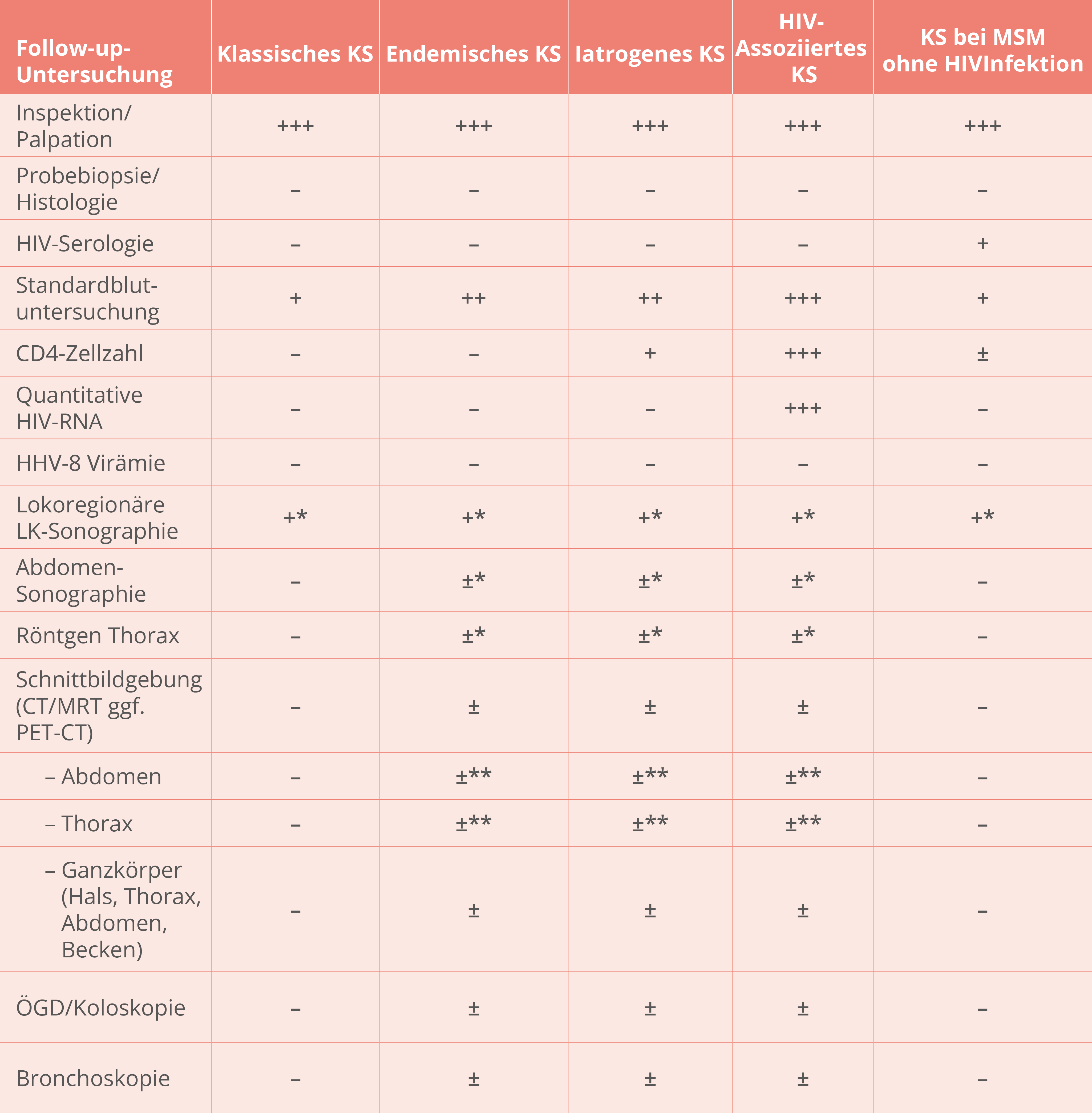
Diagnostik
Tiefe Biopsie zur histologischen Sicherung
HIV-Test
HIV-assoziiertes KS, KS bei HIV-negativen MSM und iatrogenes KS: CD4-Zellzahl
Keine HHV8-Bestimmung in der klinischen Routine, aber immunhistochemisch häufig HHV8 inratumoral aus diagnostischen Gründen nachgewiesen
Staging
Vollständige Inspektion der Haut und Schleimhaut, Palpation der Lymphknoten und Abdomen bei allen Patienten
Weitere Untersuchungen abhängig vom KS-Subtyp und auf der Basis von Symptomen, Verlauf und Befall, Sonographie ist weniger aussagekräftig als CT
Bei (V. a.) Viszeralbefall: CT-Thorax/Abdomen, ggf. Endoskopie (ÖGD, Koloskopie und Bronchoskopie)
Therapieprinzipien
Aufklärung aller Patienten: keine Heilung möglich, Wahrscheinlichkeit von
Rezidiven besteht, nach/bei Lokaltherapie neue Läsionen außerhalb des Behandlungsfeldes möglich, Hyperpigmentierungen und Ödeme (Kompression wichtig) nach Therapie möglich
Watch and wait bei guter Prognose und fehlendem Leidensdruck, Camouflage möglich
Lokaltherapie:
a. kleinflächig ≤ 1 cm2: Exzision, Kryotherapie, intraläsional Vincristin oder Vinblastin, topische Therapie
b. mittelgroß 1– 4 cm: intraläsional Vincristin oder Vinblastin, Elekrochemotherapie, Radiotherapie
c. großflächig > 4 cm und knotig, infiltrierend, oral: Radiotherapie
d. intraoral: intraläsional Vinblastin, Radiotherapie
Systemische Therapie (bei aggressiven KS, disseminiertem Befall, infiltrativem exulzerierenden Wachstum, Schleimhautläsionen, LK-Beteiligung und viszeralem Befall) z. B. mit pegyliertem liposomalen Doxorubicin oder PD-1 Inhibitor, Zweitlinie z. B. Paclitaxel möglich
Iatrogenes KS: Modifizierung oder Absetzen der Immunsuppression insbesondere mTOR-Inhibitoren aufgrund antiangiogenetischer Effekte sinnvoll
HIV-assoziiertes KS: Beginn oder Optimierung der ART (antiretrovirale Therapie)
Nachsorge
+++ zwingend erforderlich
++ erforderlich
+ optional
± Symptom- und Befundabhängige individuelle Indikation
– in der Routine nicht empfohlen
* weniger aussagekräftige Alternative zu CT-Untersuchungen
** nur wenn kein Ganzkörprer-CT indiziert ist
Weitere Informationen
Adaptiert nach S1-Leitlinie: Kaposi-Sarkom AWMF 032/025; https://register.awmf.org/assets/guidelines/032-025l_S1_Kaposi-Sarkom_2022-03.pdf (abgerufen 20.12.2024)
Das dermale und subkutane Leiomyosarkom geht von den glatten Muskelzellen der Haut aus. Die Prognose des dermalen Leiomyosarkoms ist günstig, wohingegen ein subkutanes Leiomyosarkom ein hohes Metastasierungsrisiko aufweist.
OP/Sicherheitsabstand
Dermales LMS: Primär mikroskopisch kontrolliert R0, Erweiterung des SA auf 1 cm
Subkutanes LMS: Primär mikroskopisch kontrolliert R0, wenn möglich Erweiterung des SA auf 2 cm bis zur Faszie
Diagnostik (Bildgebung)
Im Standardfall keine
Bei V. a. oder Nachweis lokoregionaler Metastasierung: LK-Sono
Bei unverschieblichen Tumoren/ V. a. tiefe Infiltration: lokoregionäre Schnittbildgebung
Adjuvante Strahlentherapie
LMS (R0) und kleine Tumoren: keine
LMS (R1) oder (R2)-Resektion, geringer Sicherheitsabstand oder bei großen Befunden (> 5 cm): empfohlen
Strahlentherapie
In palliativen, inoperablen Situationen: definitive Bestrahlung
Medikamentöse Therapie
Individuelle Therapieentscheidung z. B. Doxorubicin oder Anthrazyklin- basierte Kombinationstherapie (bei rascher Progression)
Vorschlag zur Nachsorge in risikoadaptierten Intervallen
Weitere Informationen
Adaptiert nach S1-Leitlinie Dermales und subkutanes Leiomyosarkom
AWMF 032/060; https://register.awmf.org/assets/guidelines/032-060lS_1_Dermales-subkutanes-Leiomyosarkom_2023-05.pdf (abgerufen 20.12.2024)
Kutane T-Zell-Lymphome sind eine heterogene Gruppe von Erkrankungen mit monoklonalen T-Zell-Proliferationen und sehr unterschiedlicher Prognose. Kutane T-Zell-Lymphome vom Typ der Mycosis fungoides (MF) sind als niedrig-maligne einzustufen, die MF kann über Jahre bis Jahrzehnte indolent verlaufen.
Diagnostik
Labor: CRP, Differentialblutbild, Leberenzyme, Kreatinin, LDH, Elektrolyte Weitere Laboruntersuchungen in Abhängigkeit von der geplanten Therapie
Bildgebung: Rö-Thorax, LK-Sono, Abdomen-Sono; ab Stadium IIB Ganzkörper-CT, LK-Sono, ggf. PET-CT
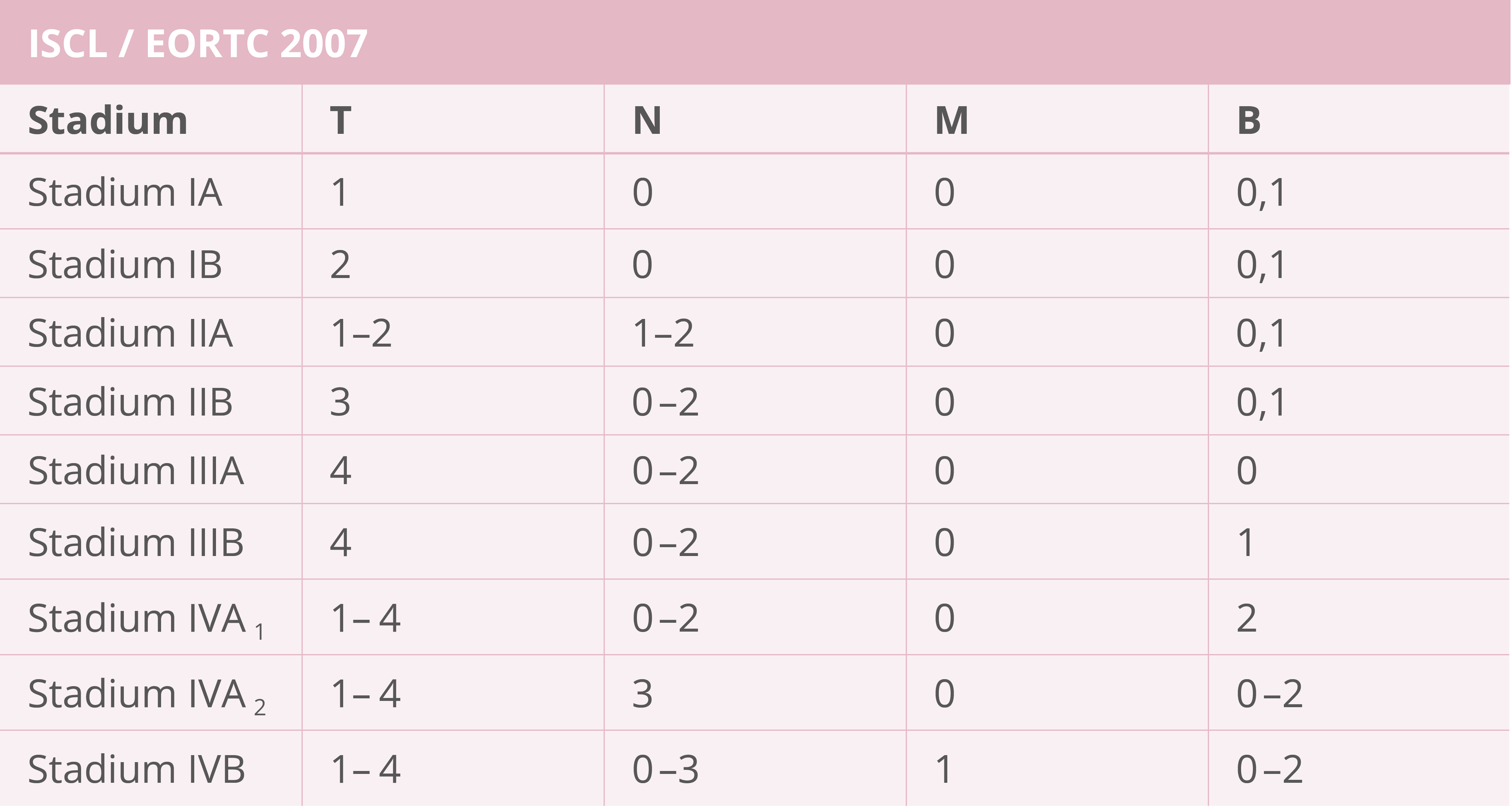
Stadieneinteilung
Stadieneinteilung
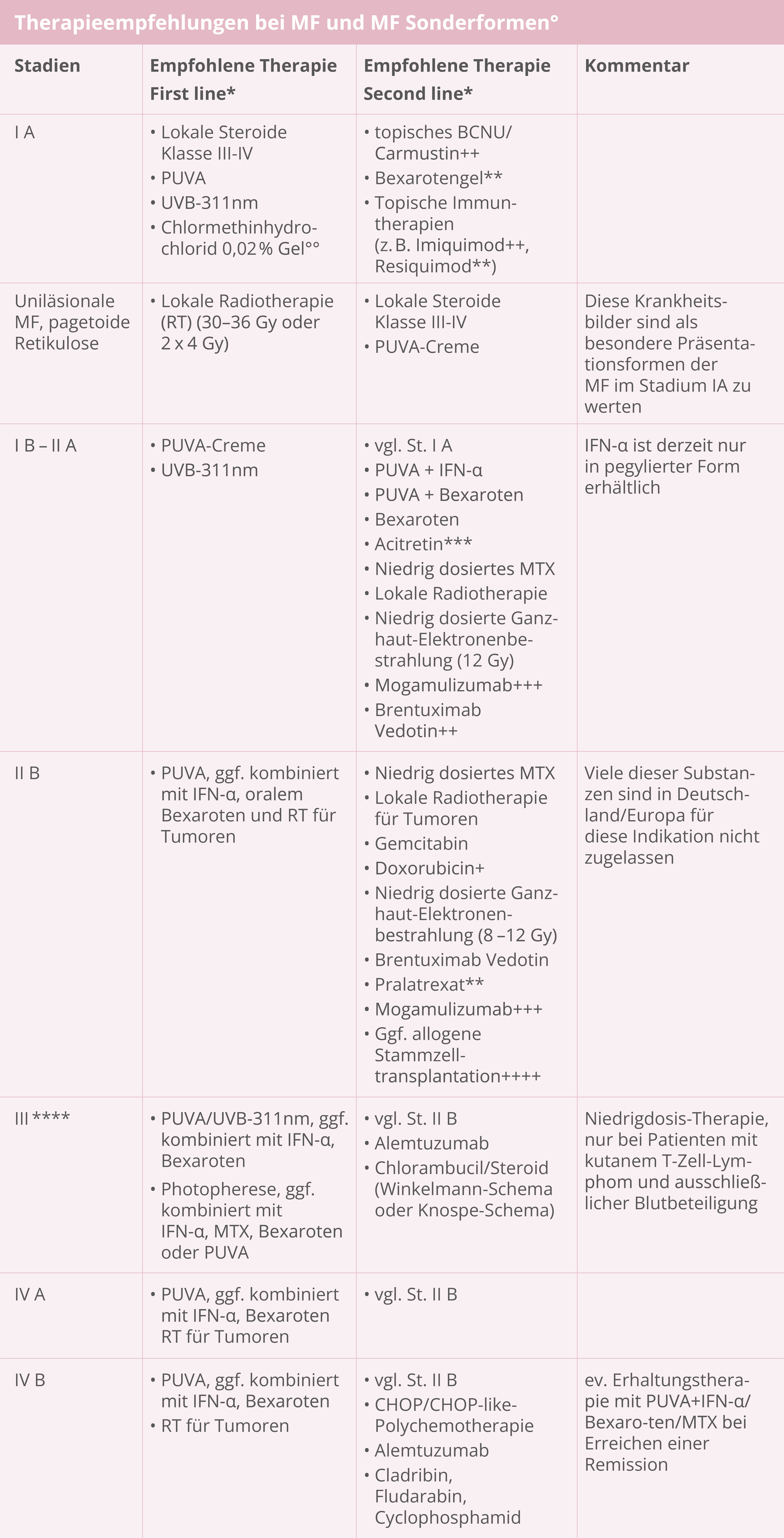
Therapie
° Individuelle multimodale Therapieoptionen stehen im Vordergrund
°° Chlormethinhydrochlorid-Gel als Lokaltherapie in allen Stadien kombinierbar
* Die Reihenfolge innerhalb einer Spalte stellt keine Wertung dar
** In Deutschland nicht zugelassen
*** Acitretin: bei Kontraindikation als Alternative zu Bexaroten möglich
**** Erythrodermatische MF: RT: Röntgenweichstrahlen oder Elektronen, ggf. Photonen
+ Pegyliertes liposomales Doxorubicin – ist im Regelfall nicht zu Lasten der gesetzlichen Krankenkassen verordnungsfähig. Für Einzelheiten zur Verordnungsfähigkeit verweisen wir auf den GBA-Beschluss.
++ Off-label Anwendung
+++ Mogamulizumab bevorzugt bei MF mit Blutbefall und Sézary-Syndrom
++++ Allo-SCT: reduzierte Konditionierung
Diagnostik
Labor: CRP, Differentialblutbild, Leberenzyme, Kreatinin, LDH, Elektrolyte Blutausstrich auf Sézary-Zellen (fakultativ, im Vordergrund steht die FACS-Analyse)
FACS, CD4/CD8 Ratio, Bestimmung der CD4+CD7- Zellen und/oder der CD4+CD26-Zellen (optional: Expression von CD158k/KIR3DL2)
Klonalitätsanalyse im Blut (PCR, BIOMED-2 Protokoll)
Knochenmarksbiopsien sind zur Diagnosestellung nicht indiziert
Bildgebung: 1. Ganzkörper-CT, LK-Sono, ggf. PET-CT
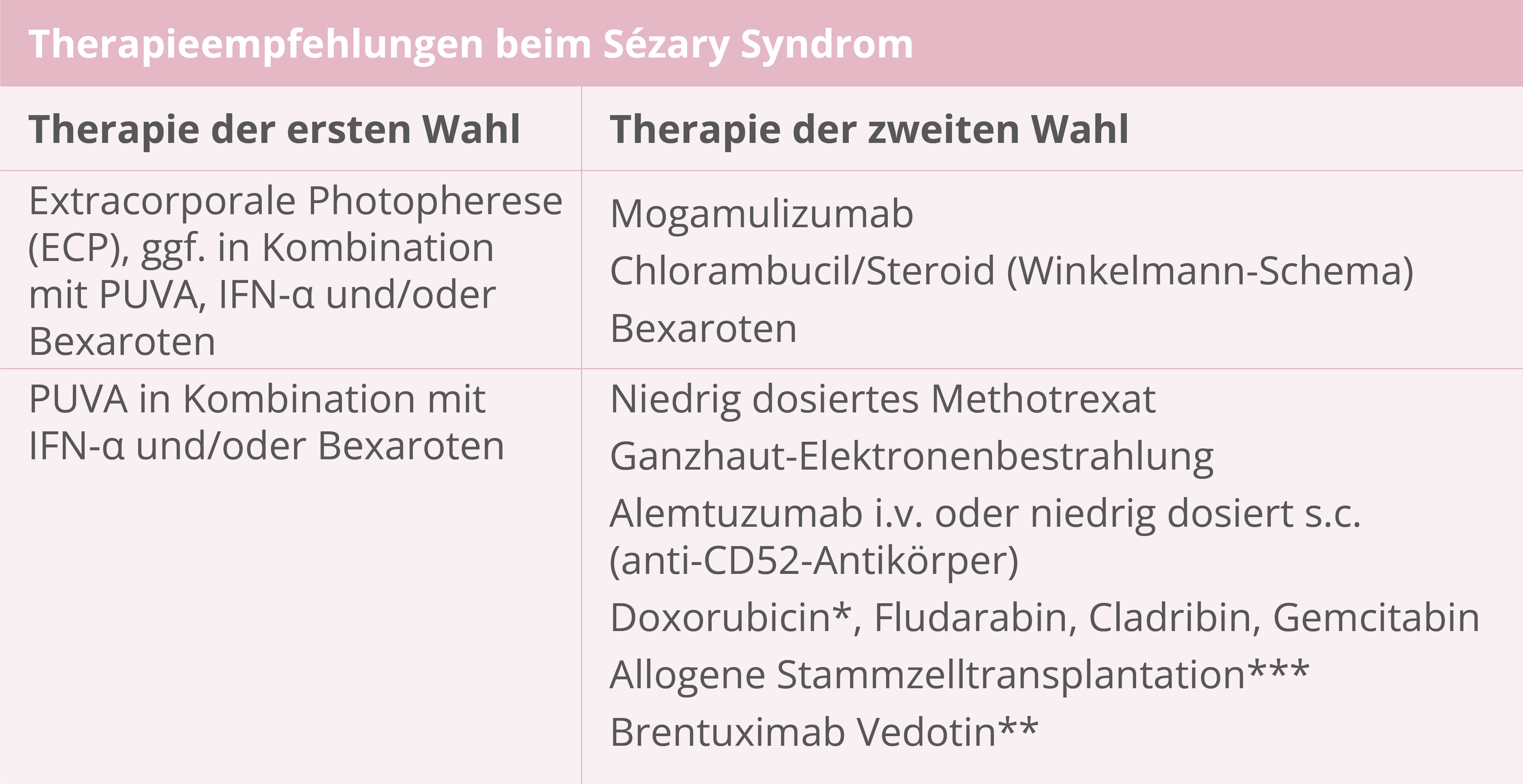
Therapie
* Pegyliertes liposomales Doxorubicin – ist im Regelfall nicht zu Lasten der gesetzlichen Krankenkassen verordnungsfähig. Für Einzelheiten zur Verordnungsfähigkeit verweisen wir auf den GBA-Beschluss.
** Off-label Anwendung
*** Für ausgewählte Patienten kann eine allogene Stammzelltransplantation indiziert sein.
Weitere Informationen
Adaptiert nach
- Olsen E, Vonderheid E, Pimpinelli N, et al. Revisions to the staging and classification of mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of Cancer (EORTC). Blood. 2007;110(6):1713-1722.
- Kim YH, Willemze R, Pimpinelli N, et al. TNM classification system for primary cutaneous lymphomas other than mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the Cutaneous Lymphoma Task Force of the European Organization of Research and Treatment of Cancer (EORTC). Blood. 2007;110(2):479-484.
- Dippel E. et al. S2k-Leitlinie - Kutane Lymphome (ICD10 C82-C86): Update 2021; J Dtsch Dermatol Ges. 2022 Apr;20 (4):537-555
* Komplette Entfernung des Tumors allseits umgeben von gesundem Gewebe inklusive eines möglichen Punktionskanals oder einer Biopsienarbe. Wenn eine weite Resektion nicht möglich oder prognosebestimmend ist, sollte eine funktionserhaltende OP mit dem Ziel einer R0-Resektion erfolgen. (siehe S3-Leitlinie Adulte Weichgewebssarkome)
** Klinische Risikofaktoren: Lokalisation (Ohr, Lippe, Schläfe), Lokalrezidiv, > 2 cm Durchmesser, Keine Verschieblichkeit vom Untergrund, Histologische Risikofaktoren: > 6 mm Eindringtiefe, Desmoplasie, perineurale Invasion, Überschreiten der Subcutis, Differenzierung G3/G4
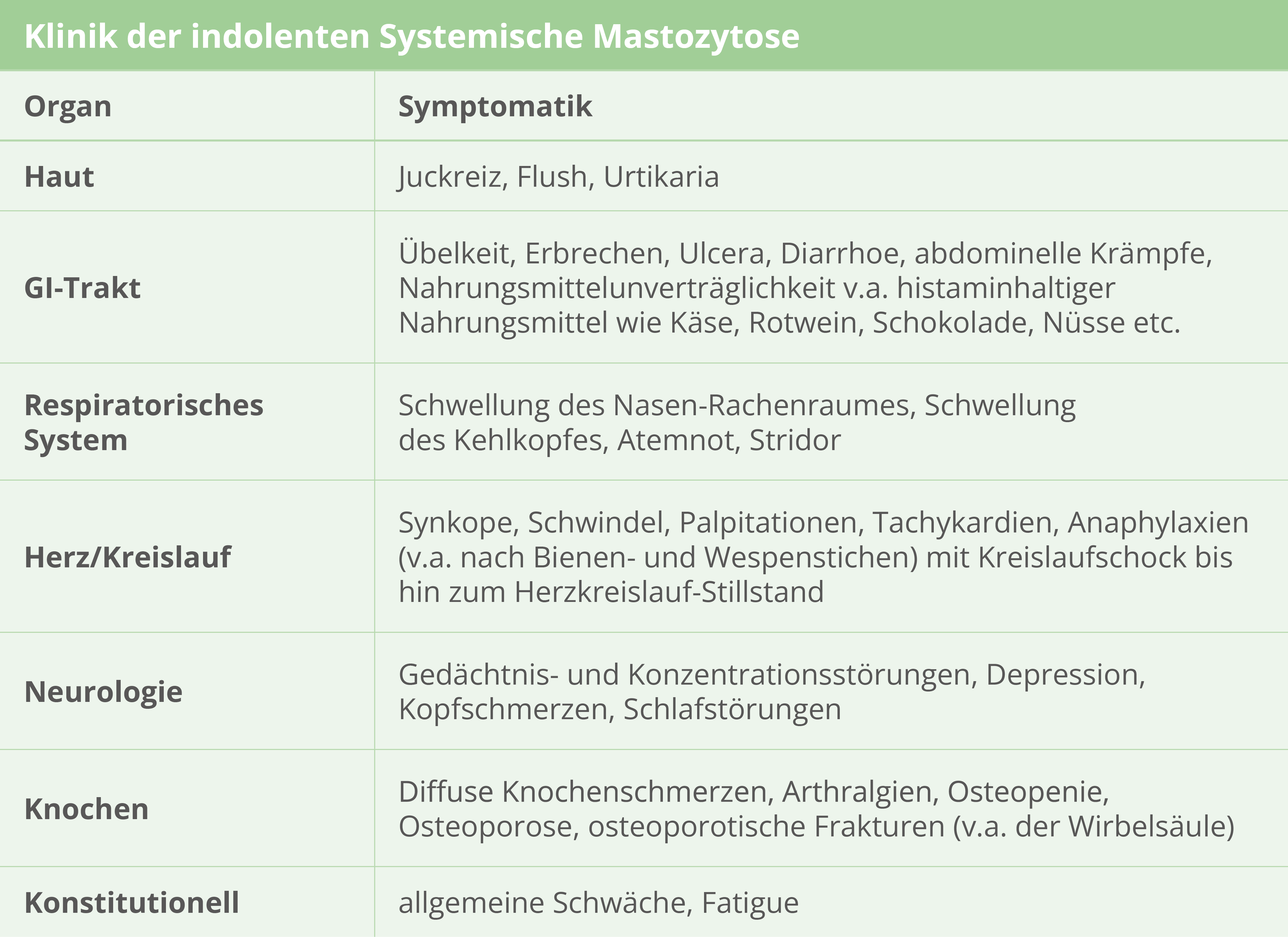
Die systemische Mastozytose ist durch die abnormale Ansammlung von neoplastischen Mastzellen im Knochenmark und möglicherweise anderen Organen gekennzeichnet. Eine kutane Beteiligung ist sehr häufig.
Kutane Mastozytose
Makulopapulöse kutane Mastozytose (Urtikaria pigmentosa)
Kutanes Mastozytom
Systemische Mastozytose
Nicht-fortgeschrittene systemische Mastozytose (non-AdvSM)
Fortgeschrittene systemische Mastozytose (AdvSM)
Definition und Diagnosestellung
Die systemische Mastozytose (SM) ist durch die abnormale Ansammlung von neoplastischen Mastzellen im Knochenmark und möglicherweise anderen Organen gekennzeichnet. Eine kutane Beteiligung ist sehr häufig.
Zur Diagnosestellung muss 1 Hauptkriterium und min. 1 Nebenkriterium oder 3 Nebenkriterien erfüllt sein.
Das Hauptkriterium: dichte, multifokale Infiltrate von min. 15 Mastzellen im Knochenmark oder anderem extrakutanen Organ.
4 Nebenkriterien
- Nachweis atypischer spindelförmiger Mastzellen
- Identifizierung einer KIT-Punktmutation (D816V)
- Spezifische Oberflächenmarker (CD2, CD30 und/oder CD25) auf Mastzellen
- Erhöhte Serumtryptasewerte > 20 μg/l
Die Mastzellinfiltrationen können zu Vergrößerungen von Organen wie Leber, LK, Milz führen, ohne Funktionseinschränkungen (B-Findings). Treten Funktionseinschränkungen auf wie Zytopenie, portale Hypertonie, Malabsoption, liegen C-Findings vor.
Die WHO-Klassifikation* beschreibt verschiedene Subtypen der systemischen Mastozytose (SM). Die Subkategorien werden in die nicht-fortgeschrittene SM „non-AdvSM“ weniger organinvasiv, normale oder leicht eingeschränkte Lebenserwartung) und fortgeschrittene SM (AdvSM mit den 3 Subtypen aggressive SM, SM mit assoziierter hämatologischer Neoplasie, Mastzellleukämie) unterteilt. Die indolente SM (ISM) fällt in die Kategorie der nicht-fortgeschrittenen SM (non- AdvSM) und ist der häufigste Subtyp, oft mit Hautbeteiligung.
* WHO Klassifikation 2022
Liegt der V.a. eine systemische Mastozytose bei o.g. Klinik vor, ist folgende Diagnostik zu veranlassen:
Diagnostik
Labor: Blutbild, Differentialblutbild, Labor inkl. Tryptase, Leberwerte, Gerinnung, Ferritin, Folsäure, Albumin, Eiweiß-Ephorese, Immunfixation, Vit. D und B12, Folsäure, CRP, beta2-Mikroglobulin
Bildgebung: LK-Sono, Abdomen-Sono, ggf. CT/MRT bei V.a. Osteolysen
Knochenmark: Aspirat und Biopsie für zytologische, histologische, immunhistochemische und durchflusszytometrische Analysen
Molekulargenetik: Nachweis von KIT-Mutationen und anderen relevanten genetischen Veränderungen.
Therapie
Symptomatische und unterstützende Therapie
Diese Therapieform ist die Grundlage der Behandlung für alle SM-Patienten, unabhängig vom Subtyp. Sie zielt darauf ab, die durch die Freisetzung von Mastzellmediatoren verursachten Symptome zu lindern. Zu den Maßnahmen gehören:
- Antihistaminika: Zur Blockierung der Wirkung von Histamin
- H2-Rezeptorblocker: Zur Linderung von gastrointestinalen Symptomen
- Mastzellstabilisatoren: Zur Verhinderung der Freisetzung von Mastzellmediatoren
- Glukokortikoide: Zur Unterdrückung von Entzündungen
- Vitamin D/Bisphosphonate: Zur Vorbeugung und Behandlung von Osteoporose
- Omalizumab: bei wiederkehrender Anaphylaxie
Therapiespezifische Ansätze für nn-AdvSM:
- Fokus auf Symptomkontrolle.
- Konsequente prophylaktische Antimediator-Therapie mit HR1- und HR2-Blockern.
- Bei Bedarf zusätzliche Gabe von Mastzellstabilisatoren, Glukokortikoiden und anderen Medikamenten.
- Behandlung der Osteoporose nach den Empfehlungen der Leitlinie Osteoporose des Dachverbandes Osteologie e.V. (DVO) mit Anpassungen für SM-Patienten, z. B. frühzeitige Einleitung der Bisphosphonat-Therapie bei einemT-Score von < –2.
- Bei therapieresistenter Osteoporose kann pegyliertes Interferon-alpha off-label eingesetzt werden.
- Avapritinib ist zur Behandlung erwachsener Patienten mit indolenter systemischer Mastozytose (ISM) mit mittelschweren bis schweren Symptomen indiziert, bei denen mit einer symptomatischen Behandlung keine ausreichende Kontrolle erzielt werden kann.
Avapritinib (AYVAKYT) ist als Monotherapie zur Behandlung erwachsener Patienten mit aggressiver systemischer Mastozytose (ASM), systemischer Mastozytose mit assoziierter hämatologischer Neoplasie (SM-AHN) oder Mastzellleukämie (MCL) nach zumindest einer systemischen Therapie indiziert.
Weitere Informationen
Adaptiert nach Onkopedia Leitlinie Systemische Mastozytose Stand Januar 2024; https://www.onkopedia.com/de/onkopedia/guidelines/mastozytosesystemische/@@guideline/html/index.html (abgerufen 20.12.2024)
Die blastische plasmazytoide dendritische Zellneoplasie (BPDCN) ist eine sehr seltene und aggressive hämatologische Neoplasie, die sich überwiegend initial an der Haut, später auch in Knochenmark, Lymphknoten und anderen Organe zeigt.
Klinik und Epidemiologie
Seltene und aggressive hämatologische Neoplasie, überwiegend an der Haut, auch Knochenmark, Lymphknoten und andere Organe. Vor allem ältere Erwachsene ca. 60–70 Jahre, es gibt Fälle bei jüngeren Personen/Kindern – männliche Dominanz (Verhältnis 3:1).
Die klinische Präsentation von BPDCN kann variieren, bei ca. 90 % der Patienten primär kutane Manifestation als kontusiforme Maculae, noduläre Läsionen oder als Tumoren. Selten als hypo- oder hyperpigmentierte Maculae.
Nach im Median 2,5 Monaten kommt es zu einer klinisch manifesten extrakutanen Ausbreitung mit Beteiligung von z. B. Knochenmark, Lymphknoten, Milz, peripheres Blut, ZNS.
Diagnostik
Anamnese und klinische Untersuchung: Identifizierung charakteristischer Hautveränderungen und anderer systemischer Symptome. ECOG, befallene Körperoberfläche mittels mSWAT kalkulieren
Hautbiopsie zur Histopathologie: Blastenartige Zellen mit einem hohen Kern-Zytoplasma-Verhältnis und Immunhistochemie: CD4, CD56 und CD123- Positivität bei Abwesenheit von pan-T, pan-B und myeloischen Markern
Knochenmarksaspiration und Knochenmarksbiopsie zur u.a. Immunphänotypisierung
Liquorpunktion: Zellzahl und Differenzierung
Bildgebung: CT-Hals/Thorax/Abdomen/Becken
Therapie
Initial erfolgt eine Einteilung der Patienten in Bezug auf eine potentielle Eignung für eine intensive Therapie nach den Kriterien ECOG-Status, Alter und Komorbiditäten.
Die first-line Therapie sollte bei diesen Patienten eine Vollremission erzielen, das Ziel ist die nachfolgende allogene Stammzelltransplantation.
- Tagraxofusp (SL-401): Tagraxofusp ist ein zielgerichtetes Fusionsprotein, das an CD123-positive BPDCN-Zellen bindet und eine toxische Wirkung durch modifiziertes Diphtherietoxin ausübt. Es ist in der EU für die Erstlinientherapie von BPDCN zugelassen und zeigt eine hohe Ansprechrate, insbesondere bei zuvor unbehandelten Patienten. Das Präparat eignet sich für beide Patientengruppen (geeignet und ungeeignet für eine intensive Therapie).
- Intensive Chemotherapie: Intensive Polychemotherapieprotokolle, die ursprünglich für akute lymphatische Leukämien (ALL) oder akute myeloische Leukämien (AML) entwickelt wurden, werden bei jüngeren und fitten Patienten eingesetzt. Diese Protokolle umfassen oft Kombinationen von Asparaginase, Methotrexat, Cytarabin und Anthrazyklinen.
- Konsolidierende Stammzelltransplantation: Nach erfolgreicher Induktionstherapie, wenn möglich konsolidierende allogene Stammzelltransplantation
- Moderat intensive Chemotherapie als Alternative zu Tagraxofusp für Patienten, die für eine intensive Therapie nicht geeignet sind: z. B. GMALL elderly
Weitere Informationen
Adaptiert nach Onkopedia Leitlinie Blastische plasmazytoide dendritische Zellneoplasie (BPDCN) Stand Januar 2022; https://www.onkopedia.com/de/onkopedia/guidelines/blastische-plasmazytoidedendritische-zellneoplasie-bpdcn/@@guideline/html/index.html (abgerufen 20.12.2024)